СОДЕРЖАНИЕ НОМЕРА
АНАТОМИЧЕСКИЕ ОСНОВЫ ВОССТАНОВИТЕЛЬНЫХ ОПЕРАЦИЙ ПРИ РЕЗЕКЦИЯХ ОКОЛОУШНОЙ СЛЮННОЙ ЖЕЛЕЗЫ Гайфуллин С. Н.
ANATOMIC BASES OF RECONSTRUCTIVE SURGERIES IN RESECTIONS OF PAROTID GLAND Gaifullin S.N.
In the article there are presented experimental-morphological and clinical investigations of the biomaterial for frame plasty when closing the parotid gland defects following the subtotal resection in case of the benign tumour process. The presented surgical method allows to avoid the formation of fistulas in the early postoperative period, provides Lucy Frey's syndrome prophylaxis in the late postoperative period; it appears to be an esthetic correction method.
ПРИМЕНЕНИЕ БИОМАТЕРИАЛА СТИМУЛЯТОР РЕГЕНЕРАЦИИ В ХИРУРГИЧЕСКОМ ЛЕЧЕНИИ ГРЫЖ ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКИ Мусин Р. З.
ALLOPLANT REGENERATION STIMULATOR USE IN THE SURGICAL TREATMENT OF THE HERNIA ANTERIOR ABDOMINAL WALL R.Z. Musin
читать статью
The prospect for Alloplant regeneration-stimulator biomaterial use in the treatment of the hernia anterior abdominal wall was substantiated. Indications for its use were determined. There were developed and implemented into clinical practice ways and methods to use Allograft injectible dosage form in hernia plasty of different localizations which do not essentially complicate surgical intervention, time of its performing isn't increased and the course of the early postoperative period is not overburdened.
МИОПЛАСТИЧЕСКАЯ РЕИННЕРВАЦИЯ ПАРАЛИЗОВАННЫХ МИМИЧЕСКИХ МОРЩИН БИОМАТЕРИАЛАМИ СЕРИИ АЛЛОПЛАНТ Хамитов Э. Т.
MIOPLASTIC REINNERVATION OF PARALYZED MIMIC WRINKLES WITH ALLOPLANT BIOMATERIALS E.T.Khamitov
читать статью
In the experiment the author studied the possibility of mioplastic reinnervation of the paralyzed mimic muscles, using our new developed Alloplant grafting biomaterial "Stimulator of neuro- and vasculogenesis with scar inhibitor". Experimentally there was analyzed and suggested in practical surgery "A biomaterial for static suspension and fixation of organs and tissues".
АЛЛОПЛАНТ В ХИРУРГИИ ПИЩЕВОДА Ионис Е. Ю.
ALLOPLANT SURGERY OF THE ESOPHAGUS. E.Yu. Ionis
читать статью
The method of esophagus wall defect plasty with Alloplant allogenic biomaterial was developed in the given work. Indications were determined for the allogenic biomaterial application in esophagus surgery. Esophagoplasty methods in esophagus surgeries in case of neuromuscular diseases, short stenoses, diverticula, benign tumours of the esophagus and esophagoorganic fistulas were developed and implemented. In case of the esophagus perforations there was developed and implemented into practice the method of strengthening the suture lines with Allotransplant.
КЛИНИКО-ЭКСПЕРИМЕНТАЛЬНОЕ ОБСЛЕДОВАНИЕ ПРИМЕНЕНИЯ БИОТРАНСПЛАНТАТА АЛЛОПЛАНТ В ХИРУРГИЧЕСКОЙ РЕАБИЛИТАЦИИ БОЛЬНЫХ С ПОСЛЕОПЕРАЦИОННЫМИ ОБЪЕМНЫМИ ДЕФЕКТАМИ МОЛОЧНОЙ ЖЕЛЕЗЫ Благодетелев И. Л.
CLINICAL AND EXPERIMENTAL STUDIES OF ALLOPLANT BIOMATERIAL USE IN SURGICAL REHABILITATION OF PATIENTS WITH POSTOPERATIVE SPACE-OCCUPYING DEFECTS OF THE MAMMARY GLAND.
I.L. Blagodetelev
читать статью
Indications to perform a single-stage mammoplasty with Alloplant biomaterial were specified in the work. There was developed the method to use the biomaterial in the surgical treatment of benign nodular mass of the mammary gland. Based on the experimental studies and clinical observations there was revealed Alloplant ability to create optimum conditions for regeneration and healing of the postresection wounds in patients with benign nodular diseases of the mammary gland. Optimum size and form of the electrodes for reomammography were determined with the aid of mathematical calculation.
ВНУТРИПЕЧЕНОЧНАЯ СТИМУЛЯЦИЯ РЕГЕНЕРАЦИИ В КОМПЛЕКСЕ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ БОЛЬНЫХ С ХРОНИЧЕСКИМИ ДИФФУЗНЫМИ ЗАБОЛЕВАНИЯМИ ПЕЧЕНИ (ЭКСПЕРИМЕНТАЛЬНО-КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ). Мингазов Р. С
INTRAHEPATIC REGENERATION STIMULATION IN A COMBINED SURGICAL TREATMENT OF PATIENTS SUFFERING FROM THE LIVER CHRONIC DIFFUSE DISEASES. (EXPERIMENTAL-CLINICAL INVESTIGATION). Mingazov R.S.
читать статью
The work has been done in the State educational Institution of Higher professional education “Bashkir Medical University, department of surgery”, Federal State Institution “The Russian Eye and Plastic Surgery Centre” of the Federal Agency for health and social development. For the first time there was developed a method to create multiple intrahepatic deport of Alloplant biomaterial which has a durative effect and reliably leading to the stimulation of the liver parenchyma regeneration with a subsequent improvement of its morphofunctional state. For the first time it was illustrated experimentally and clinically a reduction of the electrokinetic parameters of erythrocytes which adequately reflect an activity and degree of the inflammatory process in the liver parenchyma in case of its chronic diffuse lesions. It was established that positive changes in the electrophoretic motility of erythrocytes are a sensitive indicator of the performed treatment efficacy.
ЭКСПЕРИМЕНТАЛЬНО-КЛИНИЧЕСКОЕ ОБОСНОВАНИЕ ОРГАНОСОХРАНЯЮЩИХ ОПЕРАЦИЙ ПРИ ТРАВМАТИЧЕСКИХ ПОВРЕЖДЕНИЯХ СЕЛЕЗЕНКИ У ДЕТЕЙ С ПРИМЕНЕНИЕМ АЛЛОПЛАСТИЧЕСКИХ МАТЕРИАЛОВ АЛЛОПЛАНТ (ЭКСПЕРИМЕНТАЛЬНО-КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ) Валитов И.О.
EXPERIMENTAL-CLINICAL JUSTIFICATION OF ORGAN PRESERVING SURGERIES IN CASE OF THE SPLEEN TRAUMATIC INJURIES IN CHILDREN WITH THE USE OF ALLOPLANT BIOMATERIALS (EXPERIMENTAL-CLINICAL INVESTIGATION) I.O.Valitov
читать статью
It was for the first time proved in experimental practice that the use of Alloplant biomaterials in case of the spleen traumatic injuries accelerates regeneration processes in the injured organ. Hemostatic and plastic properties of the biomaterials were studied in case of the above-said injuries. Alloplant biomaterials produced in the Russian Eye and Plastic Surgery Centre, Ufa were used in children’s surgical practice with the purpose to restore the integrity of the injured spleen.
ЗАМЕЩЕНИЕ ТУБЕРКУЛЕЗНОЙ ЛЕГОЧНОЙ КАВЕРНЫ БИОМАТЕРИАЛОМ АЛЛОПЛАНТ Инченко К. С.
TUBERCULOUS LUNG CAVERN REPLACEMENT WITH ALLOPLANT BIOMATERIAL. Inchenko K.S.
читать статью
The work has been done in Moscow research-practical tuberculosis control Centre of Moscow Health Department. Experimentally it was for the first time studied the possibility to use xeno and allogeneic biological material of the connective tissue nature for closure of the tuberculous lung caverns. The morphological transformation dynamics was studied when closing the defect with the specified biomaterials. There was shown the possibility to use Alloplant biomaterial for the replacement of the tissue space – occupying defects in phthisiosurgery.
АУТОПЛАСТИЧЕСКОЕ УСТРАНЕНИЕ ТРИХИАЗА МИКРОХИРУРГИЧЕСКОЙ РОТАЦИЕЙ РЕСНИЧНО-ТКАНЕВОГО КОМПЛЕКСА
(анатомо-экспериментальное и клиническое исследование)
Уваров А. М.
AUTOPLASTIC ELIMINATION OF TRICHIASIS BY MICROSURGICAL ROTATION OF CILIARY-TISSUE COMPLEX. (Anatomic-experimental and clinical investigation) A.M.Uvarov
читать статью
The author offers a working classification of trichiasis and classification of the treatment methods. Three types of the microsurgical method of the ciliary-tissue complex rotation provide a stable medicinal and cosmetic effect and thus can be recommended for promoting them into clinical practice of ophthalmologists. There is presented a description of the trephine for cutting out a ciliary-tissue complex
ОПТИМИЗАЦИЯ ХИРУРГИЧЕСКИХ МЕТОДОВ ЛЕЧЕНИЯ БОЛЬНЫХ С НАГНОИВШИМСЯ ЭПИТЕЛИАЛЬНЫМ КОПЧИКОВЫМ ХОДОМ Валиева Э. К.
THE SURGICAL TREATMENT METHOD OPTIMIZATION OF PATIENTS WITH SUPPURATING EPITHELIAL COCCYGEAL FISTULA Valieva E.K.
читать статью
The expediency to use “Abaktolat” suture material and biomaterial for space-occupying tissue defect replacement (ТУ 42-2-537-2006) was first shown on the basis of clinical, laboratory (microbiological), cytological, instrumental investigations in case of the surgical treatment of suppurating epithelial coccygeal fistula. It is established that “Abaktolat” suture material acts bactericidally on the wound and intrahospital microflora preventing the development of suppurative inflammatory complications. There is proved high efficacy of the biomaterial use for space-occupying tissue defect replacement in the deep wound treatment of the sacral-coccygeal-gluteal region.
УВЕЛИЧЕНИЕ ОБЪЕМА КОСТНОЙ ТКАНИ АЛЬВЕОЛЯРНОГО ОТРОСТКА С ИСПОЛЬЗОВАНИЕМ АЛЛОТРАНСПЛАНТАТА Мулдашев Э.Р., Щербаков Д.А., Штеренберг Д.Г.
THE INCREASE OF VOLUME OF THE ALVEOLAR PROCESS BONE WITH THE USE OF ALLOGRAFT Muldashev E.R., Shcherbakov D.A., Shterenberg D.G.
читать статью
The features of replacement of the allogenic and xenogenic minced bone grafts in experiment on chinchilla rabbits and the periods of the regenerate formation have been investigated. We have revealed the fit of the allograft resorption speed with osteogenesis processes, that allows to get the adequate renerate in the final of replacement regeneration.
реклама
Публикации 2011г.
АНАТОМИЧЕСКИЕ ОСНОВЫ ВОССТАНОВИТЕЛЬНЫХ ОПЕРАЦИЙ ПРИ РЕЗЕКЦИЯХ ОКОЛОУШНОЙ СЛЮННОЙ ЖЕЛЕЗЫ
Гайфуллин С. Н.
ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию», г. Уфа
В статье представлены экспериментально-морфологические и клинические исследования биоматериала для каркасной пластики при закрытии дефектов околоушной слюнной железы после субтотальной резекции по поводу доброкачественного опухолевого процесса. Приведенный хирургический метод позволяет избежать формирования свищей в раннем послеоперационном периоде, обеспечивает профилактику синдрома Люси Фрей в позднем послеоперационном периоде, а также представляется как способ эстетической коррекции.
СПИСОК СОКРАЩЕНИЙ
-
ОСЖ - Околоушная слюнная железа
-
ДБА - Диспергированный биоматериал Аллоплант
-
БКП - Биоматериал для каркасной пластики
Актуальность
Прижизненное изучение органов и тканей является одной из приоритетных задач анатомии: «…лучевая анатомия – это анатомия на живом и во имя живого» - П.Ф. Лесгафт (1872). В настоящее время всё большее место в анатомических трудах занимают методы прижизненной визуализации органов и тканей: УЗИ, РКТ, МРТ. По мнению И.И. Кагана (2001), конечная цель анатомии – исследовать строение органа на живом объекте.
До настоящего времени анатомия околоушной слюнной железы (ОСЖ) изучалась на трупном материале с использованием методов макро-микропрепарирования (Баженов Д.В., 2009).
Следует выделить, как минимум, два аспекта для дальнейшей разработки клинической анатомии ОСЖ. Одна задача связана с необходимостью визуализации железы (Ушич А.Г., 2007; Денисов А.Б., 2008). В настоящее время для изучения ОСЖ не разработаны режимы неинвазивных методов диагностики (УЗИ, КТ, МРТ) (Ерадзе П.Е., 2008). Некоторые авторы отмечают возможность визуализации ОСЖ на МРТ (Трутень В.П., Выклюк М.В., 2008), другие используют МРТ для решения клинических задач (Kasaia T. et al., 2007).
Кроме того, опухолевые поражения ОСЖ, как правило, требуют хирургического лечения (Щипский А.В., 2001). При этом экскрет остаточной ткани железы после резекции, непосредственно контактируя с окружающими тканями, вызывает развитие послеоперационных свищей и синдрома Люси Фрей, возникающего в результате прорастания ветвей n.auriculotemporalis из культи слюнной железы в кожу (Денисов А.Б., 2003).
Важным аспектом клинической морфологии ОСЖ являются изучение её репаративного потенциала и анатомическое обоснование восстановительных операций на указанном органе. Известны различные местно-пластические операции (Foustanos A. et al., 2008; Anjum K. et al., 2008). Однако их выполнение не всегда представляется возможным. Следующая группа методов – это применение различных синтетических материалов (Aframian D.J., 2000; Щипский А.В., 2005). Отдельно стоит использование аллотрансплантатов (Richter G.T., 2007; Ye W.M. et al., 2008). Последние имеют различные недостатки (Munster A.M. et al., 2001).
Цель работы
Изучить синтопию околоушной слюнной железы по данным МРТ и обосновать возможность применения соединительнотканных биоматериалов для закрытия дефектов указанного органа.
Задачи:
-
Изучить синтопию околоушной слюнной железы у человека в норме на основе МР-сканирования данного органа.
-
На модели субтотальной резекции изучить репаративную регенерацию капсулы и паренхимы околоушной слюнной железы, а также реакцию тканевого ложа.
-
Исследовать восстановительные процессы капсулы и паренхимы слюнной железы при закрытии дефекта диспергированным соединительнотканным биоматериалом и биоматериалом для каркасной пластики.
-
Изучить возможность клинического применения разработанных биоматериалов для закрытия дефектов околоушной слюнной железы и оценить полученные результаты с помощью МРТ.
Материалы и методы исследования
Метод МР-сканирования околоушной слюнной железы
МР-исследования производились в отделе МРТ ФГУ «Всероссийский центр глазной и пластической хирургии» (зав. отделом - к.м.н. Кантюкова Г.А.) на магнитно-резонансном томографе Opart фирмы «TOSHIBA» с напряженностью магнитного поля 0,35 Тл. Использовалась катушка QD Head Coil. Режимы исследования: Т1, Т2, FLAIR (с подавлением жира) и STIR (с подавлением воды). Для создания электронной базы пациентов и морфометрических исследований на ОСЖ использовалась программа eFilm Workstation 2.1.2® фирмы Merge Healthcare.
На первом этапе произведена случайная выборка из 200 МР-томограмм головы за 2007-2008 гг. у лиц без патологии ОСЖ - первая группа МР-исследования (n=200). Произведенная выборка служила для определения режимов и проекций, в которых железа визуализируется наиболее четко.
На следующем этапе нашей работы для прицельного исследования ОСЖ в норме специально для нашего томографа были отработаны следующие параметры программ:
Т1: TR=550, TE=15, FOV=25×25 cm, Matrix=192×256. Т2: TR=5500, TE=160, FOV=26×26 cm, Matrix=225×336. FLAIR: TR=7000, TE=120, FOV=29×29 cm, Matrix=176×256. STIR: TR=2000, TE=30, FOV=22×22 cm, Matrix=128×256.
Далее приводится терминология МРТ по Э. Блинку (2000). T1 релаксация – время, необходимое для достижения 63% от первоначального уровня намагниченности. Т1 релаксация протекает за 600 мс. Параметры: TR 600 и TE 10 (параметры могут варьировать в небольших пределах). Так, вода будет темной, а жировая ткань - яркой.
T2 релаксация – время, необходимое для достижения 37% количества смещенных по фазе протонов от первоначального значения. Т2 протекает за 5 мс. Параметры - TR 3000 и TE 120 позволяют добиться полной Т1 релаксации. Вода в режиме Т2 выглядит яркой, а другие ткани – оттенки серого.
TR – repetition time (время повторения) – время между двумя импульсами возбуждения. TR – время между двумя 90º импульсами возбуждения.
TE – echo time (время эхо) – время между 90º импульсом возбуждения и эхо.
FOV – field of view (поле наблюдения) определяет размер исследуемой области пациента, которую мы собираемся посмотреть.
Для сканирования целого среза полный процесс кодирования среза, фазы и частоты должен быть повторен столько раз, сколько определено параметром Matrix.
FLAIR – Fluid Attenuated Inversion Recovery (восстановление с инверсией и ослаблением сигнала жидкости) - время инверсии (TI) 1900 мс в комбинации с длинным TE. FLAIR обычно используется для изучения множественных склерозов, которые светятся «подобно лампочке».
TI – inversion time (время инверсии) - это время между 180º и 90º импульсами возбуждения. TI оказывает сильное воздействие на контраст изображения в IR последовательностях.
STIR - Short TI Inversion Recovery - восстановление с инверсией с коротким TI. При использовании TI 90 мс в системе с полем 0,35 T. При этом происходит подавление сигнала от жировой ткани.
В результате были сформированы 2 возрастные группы: первый период зрелого возраста (21-35 лет) – 51 исследование; второй период зрелого возраста (36-55 лет) – 49 исследований (n=100). В первую возрастную группу вошли 28 лиц женского пола и 23 лица мужского пола. Во вторую возрастную группу вошли 30 лиц женского пола и 19 лиц мужского пола.
В отдельную группу вошли прицельные МР-исследования ОСЖ (n=6) у пациентов после резекции смешанной опухоли и пластики дефекта с использованием биоматериала для каркасной пластики (БКП) серии Аллоплант (ТУ 42-2-537-2006). МР-сканирование ОСЖ выполнялось через год, 2,5 года и через 5 лет после оперативного лечения.
Материалы и методы экспериментально-морфологических исследований
Экспериментальные исследования проведены на 93 крысах породы Вистар. Выполнялся линейный разрез в проекции ОСЖ. Препарировалась поверхность железы и затем под микроскопом МБС-2 срезался её поверхностный слой толщиной 1 мм.
В контрольной серии опытов кожа ушивалась над поверхностью дефекта (n=31). В первой опытной серии поверхность дефекта покрывалась диспергированным биоматериалом Аллоплант (ДБА), устойчивым к реактивной среде gl. Parotidea (n=31). Во второй опытной серии (n=31) поверхность дефекта покрывалась БКП. Животные выводились из опыта на 7-е, 45-е и 120-е сутки. Для гистологического исследования забиралась околоушная слюнная железа с прилежащими тканями, биоматериалом и кожей.
Полученные ткани консервировались в 10% нейтральном формалине. Затем готовились срезы толщиной 7 мкм и окрашивались гематоксилином и эозином, по Маллори, а также по Ван-Гизону. Препараты изучались под поляризационным (МИН-8) и световым (MC-50) микроскопами с фотонасадкой Nikon Coolpix 4500.
Оценка динамики реактивных процессов в ОСЖ производилась по ширине гистотопографических зон с использованием функции «length» программы Biovision при увеличениях ×10, ×40: зона деструкции – ткань железы, подвергшаяся деструктивным изменениям; зона воспалительной инфильтрации – область, инфильтрированная полиморфноклеточными лейкоцитами, а также зона пролиферации, постепенно сменяющая первые две зоны.
Также определялась плотность дистрофически измененных клеток секреторного эпителия на единицу площади. Для этого при световой микроскопии выявлялась условно интактная зона ОСЖ. Затем производились микрофотографирование и передача данных на ПК. После чего определялось количество дистрофически измененных клеток на 55 тыс. кв. мкм с помощью функции «count» программы Biovision 3.0. Полученные значения суммировались и переводились в программы Microsoft Excel 2007 и Statistica 7.0 для построения графиков.
Следующим этапом работы было определение индекса гипертрофии по А.Б. Денисову (2006). Так рассчитывалась площадь 20 произвольно выбранных ацинусов в условно интактной зоне слюнной железы в различные сроки эксперимента. При этом использовалась функция «area» программы Biovision 3.0.
Анализ соответствия вида распределения признака (размеры околоушной слюнной железы (по данным МРТ), ширина гистотопографических зон и др.) закону нормального распределения производился методами Лиллиефорса и Шапиро-Уилка W в программе Statistica. Так распределение исследуемых признаков было приближено к нормальному.
Для описания признаков (размеры железы и др.) использовались следующие параметры программы Statistica: среднее значение признака; среднее квадратическое отклонение (σ).
Сравнение полученных результатов в различных сериях опытов производилось с использованием параметрического метода (t-критерий Стьюдента для независимых групп). Проверка нулевой статистической гипотезы выполнялась процедурой «различия между двумя средними (нормальное распределение)» в программе Statistica. В случае, если p>0,05, различия признавались статистически незначимыми. Альтернативная гипотеза принималась при р<0,05, такие различия считались статистически значимыми.
Клиническая характеристика наблюдаемых групп пациентов
В основу диссертации положен анализ хирургического лечения 30 пациентов с доброкачественными опухолями ОСЖ с использованием БКП на базе отделения пластической хирургии и регенеративной стоматологии ФГУ «Всероссийский центр глазной и пластической хирургии» (зав. отделением - д.м.н. Вырупаев С.В.) с 2000 по 2009 годы (n=30). Так, прооперированы пациенты в возрасте от 21 года до 55 лет, которым произведена паротидэктомия по поводу доброкачественного опухолевого процесса ОСЖ. Опытную группу составили 23 женщины (76,7%) и 7 мужчин (23,3%). В 29 случаях (96,7%) гистологически идентифицирована смешанная опухоль, в 1 случае (3,3%) – мономорфная аденома. Структура сопутствующих заболеваний соответствует таковой в контрольной группе и структуре фоновых заболеваний, характерных для данной возрастной группы. Также прооперировано 8 пациентов в возрасте от 29 до 65 лет с гигантскими смешанными опухолями ОСЖ (5 женщин и 3 мужчин). Эти 8 лиц не вошли в статистику.
На следующем этапе проведен ретроспективный анализ работы отделения опухолей головы и шеи Республиканского клинического онкологического диспансера (г. Уфа).
Выражаем признательность руководству онкодиспансера и лично директору клиники профессору Ганцеву Ш.Х. за предоставленную возможность работы в архиве учреждения и оказанную методическую помощь.
В период с 2005 по 2009 годы отобраны пациенты с доброкачественными опухолями ОСЖ. При этом в контрольную группу вошли лишь 30 пациентов возрасте от 21 года до 55 лет с локализацией опухолевого процесса в наружной части ОСЖ и без прорастания лицевого нерва. Контрольную группу составили 21 женщина (70%) и 9 мужчин (30%). Сопутствующие заболевания имели все 30 пациентов. Из них – гипертоническая болезнь у 11 (36%), нарушения ритма у 3 (10%), заболевания органов дыхания у 5 (17%), вегетососудистая дистония у 5 (17%), сахарный диабет у 2 (7%), варикозное расширение вен нижних конечностей у 3 (10%), миокардиодистрофия у 1 (3%).
Оцениваемые качественные признаки в основной и контрольной группах (ранние и поздние послеоперационные осложнения) рассматривались как признаки бинарного типа. Определялась относительная частота признака, выраженная в процентах и в программе Excel строились столбиковые диаграммы. Доверительные интервалы для качественных признаков определялись по таблице, представленной О.Ю. Ребровой (2002), для исследований, в которых n≤30. Оценка достоверности различий качественных признаков проводилась с использованием критерия χ2 с поправкой Йетса. С помощью процедуры «Таблицы 2×2:хи/V/ви/Макнемара/точный Фишера» в программе Statistica производилось построение четырехпольных таблиц.
Техника операции
Положение больного лежа на спине с валиком под лопатками, голова повернута в здоровую сторону. Впередиушной разрез начинается в волосистой части височной области на высоте верхней точки ушной раковины, идёт в предушной области вниз, по гребню козелка, повторяя его форму, далее - по границе мочки уха. Затем разрез поворачивает вверх и идёт, отступя 5 мм от границы ушной раковины с кожей заушной области. Между верхней и средней третями ушной раковины линия разреза приобретает ломаный характер и идёт в волосистой части, параллельно её границе вниз и кзади на 4-5 см.
Отсепаровывается кожа сначала в заднем, затем в переднем отделе. При этом выделяется большой ушной нерв. После обнажения ствола лицевого нерва в его плоскости осуществляется паротидэктомия. Замещение объёмного дефекта мягких тканей, возникшего после удаления околоушной слюнной железы, осуществляется с помощью БКП. Трансплантат выкраивается по форме удаленной железы и фиксируется по периферии рассасывающейся нитью «викрил». Рана ушивается послойно. На кожу накладывается скрытый шов. Рана дренируется сутки.
Результаты исследования и их обсуждение
Случайная выборка МР-томограмм головы показала, что ОСЖ чаще всего (в 18,63% случаев) визуализируется в режиме Т1 в сагиттальной проекции. Наиболее редко железу удается выявить в режиме Т2 в коронарной проекции (в 0,98% случаев). При этом, по данным С.В. Серебрякова с соавт. (2005) ,наиболее информативными являются режимы Т1 и Т2 в коронарной плоскости.
Разработанный нами метод прицельного МР-сканирования ОСЖ позволяет стабильно (в 100%) визуализировать железу и оценивать топографо-анатомические взаимоотношения, структуру органа, размеры с погрешностью до 0,1 мм. Так, по данным прицельной МР-томографии, ОСЖ граничит со следующим костными структурами: кпереди и медиально – ветвь нижней челюсти, над железой – наружный слуховой проход (костная часть), кзади от органа – сосцевидный отросток височной кости. МРТ также позволяет изучить мышечные образования, окружающие ОСЖ. Кпереди и медиально – жевательная и височная мышцы, медиально – шилоглоточная и шилоязычная мышцы, а также крыловидные мышцы; позади железы – заднее брюшко двубрюшной мышцы, полуостистая мышца, ременная мышца; кзади и книзу от ОСЖ – грудино-ключично-сосцевидная мышца. Режим Т2 в аксиальной (горизонтальной) и в коронарной (фронтальной) проекциях позволяет визуализировать сосудистые образования в толще ОСЖ – занижнечелюстная вена и наружная сонная артерия. Также данный режим обнаруживает сосуды, расположенные медиальнее глоточного отростка железы, – внутренняя яремная вена и внутренняя сонная артерия. Полученные данные согласуются с результатами работ зарубежных авторов (Moeler T.B., Reif E., 2007; Leea Y.Y.P. et al., 2008).
Прицельное МР-исследование также показало, что в первом периоде зрелого возраста у здоровых лиц наибольшим является вертикальный размер в коронарной (фронтальной) проекции (4,76±0,43 см); а наименьшим -поперечный размер в коронарной проекции (1,37±0,18) см. У лиц второго периода зрелого возраста максимальный размер также вертикальный в коронарной проекции (4,9±0,35 см), а минимальный размер – переднезадний в аксиальной проекции (1,88±0,34 см). Следует отметить, что полученные различия между двумя выбранными возрастными группами являются статистически незначимыми и совпадают с данными других авторов (Серебряков С.В., 2005; Трутень В.П. с соавт., 2008). Известно, что опухолевые поражения ОСЖ, как правило, требуют хирургического лечения (Юдин Л.А., Кандрашев С.А., 1997; Щипский А.В., 2001). Однако по данным ряда авторов оперативные вмешательства на слюнных железах сопряжены с возможными осложнениями в результате контакта железы с дермой (Пачес А.И., 2000; Ушич А.Г., 2007). Наиболее частыми из них являются: синдром Люси Фрей, возникающий в результате прорастания ветвей n.auriculotemporalis в кожу, послеоперационные свищи, объемные дефекты тканей (Ghanem T. et al., 2009).
Целью оперативных вмешательств на ОСЖ является не только резекция опухоли и профилактика Фрей синдрома, но и органосохранность железы (Hancock B.D., 1999), а также стимуляция её репаративного потенциала (Kagami H. et al., 2000). Известно, что ОСЖ является не только железой активно участвующей в пищеварении, изучены также её инкреторная (Яковлева В.В., 1991), иммунная (Шипкова Т.П., 1996; Яковлева В.В., 1991) и выделительная (Коропов В.М., 1949) функции, а также связь с другими важнейшими железами, например, с поджелудочной железой (Illrano T. et al., 1991). Вышеизложенное требует разработки методов закрытия дефектов ОСЖ при хирургических вмешательствах на данном органе.
Известно использование биоматериалов Аллоплант в челюстно-лицевой хирургии (Мулдашев Э.Р., 1976-1993), в частности – применение БКП (Сельский Н.Е., 1992). По данным Э.Р. Мулдашева с соавт. (2005) биоматериалы Аллоплант при их локальном введении стимулируют пролиферацию мезенхимальных стволовых клеток.
C учетом изложенного, нами был предпринят второй этап настоящей работы, который выполнялся на базе отдела морфологии ФГУ «Всероссийский центр глазной и пластической хирургии» (зав. отделом проф. Муслимов С.А.). Целью данного этапа явилось изучение возможностей биоматериалов Аллоплант в хирургии ОСЖ.
В контрольной серии в ранние сроки в зоне, прилежащей к поверхности среза, выявляется деструкция паренхимы железы на глубину 403±64,8 мкм. Дольки железы фрагментируются, утрачивают характерную форму. Глубже определяется зона воспалительной инфильтрации шириной 653±37,7 мкм. В инфильтрате определяются эозинофилы, макрофаги, лимфоциты. В серии с использованием ДБА на 7-е сутки зона деструкции в 1,39 раза шире, в сравнении с контролем (p<0,01). При этом в исследуемые сроки зона воспалительной инфильтрации имеет в 1,29 раза большую ширину, чем в контрольной серии (p<0,01). Наблюдаемые явления, возможно, объясняются обтурацией выводных протоков ОСЖ фрагментами ДБА (рис. 1). Известно, что застой экскрета ведёт к атрофии паренхимы ОСЖ. (Денисов А.Б., 1985).
В последующие сроки (45-е сутки) в контрольной серии указанные зоны уменьшаются по ширине в 2,37-2,9 раза. На фоне применения ДБА в первой опытной серии ширина зоны деструкции достоверно не отличается от данных контрольной серии (p>0,05). Зона воспалительной инфильтрации на 45-е сутки составляет 175% от значения (p<0,001), полученного в контроле, что также объясняется нарушением оттока экскрета. По данным А.Б. Денисова (2003), при застое экскрета ОСЖ полностью исчезают ацинусы, на их месте остаются лишь эпителиальные ходы, выстланные плоским эпителием.
Однако на 120-е сутки в первой опытной серии выделенные зоны не обнаруживаются (рис. 1), что, по-видимому, объясняется полной резорбцией фрагментов ДБА и восстановлением проходимости выводных протоков ОСЖ. А.Г. Бабаева и Е.А. Шубникова (1979) также наблюдали полное восстановление массы и гистоструктуры ОСЖ после реканализации стенонова протока. 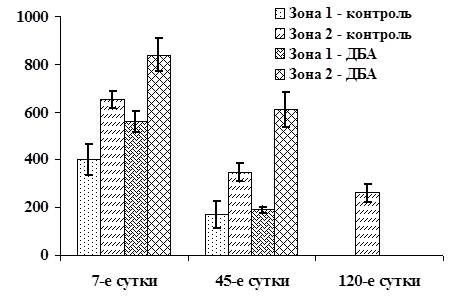
Рис. 1. Ширина патологических зон в паренхиме ОСЖ после субтотальной резекции ±1σ, мкм. Зона 1 – зона деструкции, Зона 2 – зона воспалительной инфильтрации (пролиферации). Контроль – контрольная серия; ДБА – первая опытная серия.
В контрольной серии в отдаленные сроки обнаруживается зона пролиферации шириной 263,4±37,54 мкм, представленная грубой волокнистой соединительной тканью (рис. 1 – 120-е сутки). Так, регенераторный потенциал ОСЖ, отмеченный многими исследователями (Cherry C.P., Glucksman A., 1959; Бабаева А.Г., 1979 и др.), в контрольной серии остается нереализованным: в области дефекта железы формируется грубоволокнистая соединительная ткань (рубец). Причинами низкого уровня репаративных процессов в паренхиме ОСЖ в приведенной серии, возможно, служат непосредственный контакт ткани железы с дермой, а также агрессия экскрета железы, инициирующая и поддерживающая хронический воспалительный процесс, хотя другие авторы отводят роль иным факторам. Так, А.Б. Денисов (2004) отмечает, что посттравматическая регенерация больших слюнных желез зависит от возраста индивида и механизма повреждения. А.Г. Бабаева (1979) к приведенному ряду относит такой фактор, как восстановление оттока экскрета ОСЖ.
Следует отметить, что ДБА оказывает положительное действие на регенерацию капсулы ОСЖ в отдаленные сроки эксперимента, по-видимому, за счет улучшения кровоснабжения - процессов неоваскулогенеза. Известно, что репаративные процессы в соединительной ткани проходят быстрее при нормализации микроциркуляции (Petersen W. et al., 2002).
Во второй опытной серии с БКП на границе биоматериала и гиподермы отсутствует зона деструкции. В данной серии опытов также не представляется возможным выделить гистотопографические зоны, характерные для других серий. БКП серии Аллоплант проходит технологическую препаровку и мембранолиз в соответствии с ТУ 42-2-537-2006, в результате происходит потеря антигенных свойств, токсичности и раздражающего действия на ткани в области трансплантации (Мулдашев Э.Р., Шангина О.Р., Хасанов Р.А., 1974-2009).
Во всех трех сериях опытов в ранние сроки в периферической (условно-интактной) зоне паренхимы ОСЖ обнаруживаются ацинарные клетки, находящиеся в состоянии гидропической дистрофии. Данные клетки обнаруживаются в паренхиме ОСЖ в норме в незначительных количествах и являются дефинитивными формами гландулоцитов (Денисов А.Б., 2006).
В более поздние сроки происходит постепенное уменьшение количества дистрофически измененных клеток. Так, в первой опытной серии на 7-е сутки плотность указанных клеток в 1,45 раза выше в сравнении с контрольной серией (p<0,01). На 45-е сутки на фоне применения ДБА происходит увеличение плотности измененных гландулоцитов, также определяются микрокисты, свидетельствующие о явлениях некроза ацинусов. По-видимому, частицы ДБА нарушают отток экскрета из железы, обтурируя выводные протоки. Так, по данным А.Г. Бабаевой (1979) заращение стенонова протока приводит к дистрофии, а затем и к атрофии ацинарной ткани ОСЖ.
Во второй опытной серии при использовании БКП для закрытия дефекта ОСЖ плотность дистрофически измененных клеток на 7-е сутки на 17% ниже, чем в контроле (p<0,05). На 45-е сутки указанный показатель в 2,1 раза меньше (p<0,001) в сравнении с контрольной серией (рис. 2). В то же время в области контакта паренхимы ОСЖ с трансплантатом в отдаленные сроки (45-120-е сутки) формируется зона пролиферации с одной стороны представленная пролиферирующими элементами паренхимы органа, о чем свидетельствуют множественные митозы в ацинарной ткани данной области. Сам трансплантат постепенно замещается плотной оформленной соединительной тканью, формируя капсулу ОСЖ толщиной 150-250 мкм. 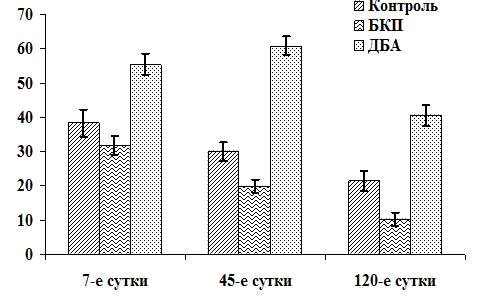
Рис. 2. Плотность дистрофически измененных клеток железистого эпителия в околоушной слюнной железе крысы на фоне экспериментальной травмы с последующей подсадкой биоматериалов. Ось ординат: число клеток на единицу площади (55 тыс. мкм2). Ось абсцисс: сроки эксперимента.
Величина индекса гипертрофии по А.Б. Денисову (2006) в различных сериях эксперимента составляла от 2,3 до 2,76. Показатели гипертрофии ацинусов во всех трех сериях имели статистически незначимые отличия (p>0,05).
Процессы, протекающие в паренхиме ОСЖ при подсадке БКП, могут объясняться его составом. По данным E. Anitua et al. (2006), комплекс коллагена, фибрина и протеогликанов является источником медиаторов, активирующих клетки фибробластического дифферона.
Как отмечалось ранее, биоматериалы серии Аллоплант являются аттрактантами мезенхимальных стволовых клеток. Приведенные механизмы реализуют регенераторный потенциал ОСЖ и способствуют пролиферации элементов паренхимы органа.
Морфометрический подсчет площади ацинусов показал, что во всех трех сериях происходит компенсаторная гипертрофия паренхимы ОСЖ. При этом не обнаружено достоверных отличий между сериями в различные сроки эксперимента.
Таким образом, использование ДБА для закрытия дефекта ОСЖ не целесообразно, так как при этом происходит обтурация выводных протоков железы, ведущая к дистрофии ацинарной ткани. Напротив, при трансплантации БКП для решения поставленных задач сохраняется гистоструктура железы. Более того, можно говорить о биостимулирующем дейстивии трансплантата на паренхиматозные элементы в исследуемые сроки. Также БКП изолирует клетки-мишени в коже от прорастания волокон n. ariculotemporalis.
Приведенные экспериментальные данные позволяют рекомендовать БКП для закрытия дефектов слюнных желез в клинической практике.
В настоящее время для профилактики и лечения синдрома Люси Фрей разработан целый ряд приемов и методик. Так, известны различные модификации местно-пластических операций (Asal K. et al., 2005; Anjum K. Et al., 2008). Следует отметить, что выполнение местно-пластических операций не всегда представляется возможным ввиду отсутствия материала. Следующей группой является применение синтетических материалов (Aframian D.J., 2000), которые не нашли широкого применения в клинической практике. Отдельную группу составляют методики использования аллотрансплантатов (Bonanno P.C., 1994; Ursick J.A., 2006; Ye W.M. et al., 2008).
Завершающим этапом нашей работы явилось клиническое применение БКП при закрытии дефекта ОСЖ и наблюдение пациентов в динамике с использованием разработанного метода МРТ. Клиническая часть работы выполнялась на базе отделения пластической хирургии и регенеративной стоматологии ФГУ «Всероссийский центр глазной и пластической хирургии» (зав. отделением - д.м.н. Вырупаев С.В.). Контрольная группа – ретроспективное исследование, выполненное на базе Республиканского онкологического диспансера г. Уфы. В обеих группах участвовали пациенты с доброкачественными опухолями наружной части ОСЖ.
Анализ результатов хирургического лечения доброкачественных опухолей ОСЖ показал, что удаление опухоли с использованием классического доступа к ОСЖ без первичной пластики дефекта мягких тканей приводит к осложнениям в послеоперационном периоде (рис. 3). 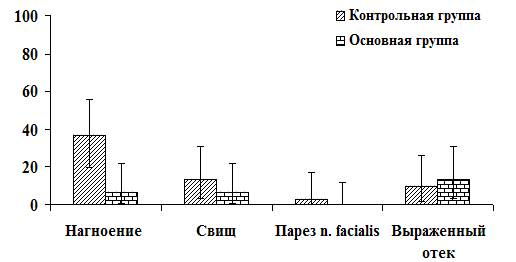
Рис. 3 Относительная частота ранних послеоперационных осложнений в двух группах пациентов, % и 95% доверительные интервалы.
Нагноение операционной раны наблюдалось у 11 (37%) пациентов, формирование свища – у 4 (13%), возможны также парез лицевого нерва и выраженный отек в области оперативного вмешательства. Первое место среди поздних послеоперационных осложнений занимает синдром Люси Фрей 22 случая (73%), косметический дефект отмечен у 16 пациентов (53%). Также возможны повреждение лицевого нерва во время операции и развитие паралича VII пары на стороне оперативного вмешательства (рис. 4).
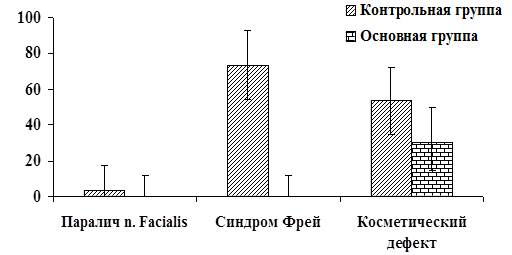
Рис. 4 Относительная частота поздних послеоперационных осложнений в двух группах пациентов, % и 95% доверительные интервалы.
Предложенный нами хирургический доступ к железе является анатомически (Nouraci S.A. et al., 2006) и эстетически (Ghanem T. et al., 2009) обоснованным, а выделение височной ветви лицевого нерва исключает возможное его повреждение во время операции. Клиническое применение БКП показало, что данный трансплантат препятствует формированию свища и прорастанию ветвей n. auriculotemporalis в кожу околоушно-жевательной области лица. В опытной группе не наблюдалось случаев развития синдрома Люси Фрей, а также в 70% случаев была достигнута косметическая коррекция. Критерий χ2 с поправкой Йетса для ранних послеоперационных осложнений показал, что частота гнойных осложнений в опытной группе достоверно ниже, чем в контроле (p=0,012). Другие ранние послеоперационные осложнения в соответствии с приведенным критерием не имели статистически значимых отличий. В опытной группе не наблюдалось случаев развития синдрома Люси Фрей (критерий χ2, p=0,00003), а также в 70% случаев была достигнута косметическая коррекция, что статически незначимо (критерий χ2, p=0,06).
Р-исследование ОСЖ, выполненное в отдаленные сроки (1 год и 5 лет) после хирургического лечения смешанной опухоли органа, подтвердило отсутствие рецидивов заболевания. Структура ОСЖ отражала её активное функциональное состояние. На Т2-взвешенных МР-томограммах через год после операции наблюдалась неоднородность структуры трансплантата, свидетельствующая об активности процессов замещения. Как показано в исследовании Р.Т. Нигматуллина (1994), для данного вида Аллопланта характерны фронтальный и диффузно-очаговый типы замещения.
Метод хирургического лечения доброкачественных опухолей ОСЖ и гигантских доброкачественных опухолей ОСЖ с использованием БКП внедрен в клиническую практику отделения пластической хирургии и регенеративной стоматологии Центра, а также в практику специализированных отделений Республиканских онкологических диспансеров.
Заключение и практические рекомендации
МР-томография в режимах Т1, Т2, FLAIR и STIR позволяет стабильно визуализировать ОСЖ, исследовать её размеры в различные возрастные периоды, а также изучить топографо-анатомические взаимоотношения данного органа с окружающими тканями и пересаженным трансплантатом в различные сроки после подсадки.
Закрытие дефектов ОСЖ биоматериалом для каркасной пластики является эффективным методом восстановления анатомической целостности капсулы и стимуляции репаративной регенерации элементов паренхимы в органе. На фоне применения биоматериала для каркасной пластики с целью закрытия дефекта ОСЖ в ранние сроки не определяются зоны деструкции и воспалительной инфильтрации. Плотность дистрофически измененных гландулоцитов в условно интактной зоне в 1,2-1,89 раза ниже, чем в контрольной серии. Частичная резекция ОСЖ приводит к локальному фиброзу или формированию кисты, заполненной экскретом железы. В ранние сроки образуются гистотопографические зоны деструкции и воспалительной инфильтрации, которые в отдаленные сроки замещаются грубой волокнистой соединительной тканью. Закрытие дефекта околоушной слюнной железы диспергированным биоматериалом Аллоплант снижает агрессию экскрета железы. Однако фрагменты ДБА вызывают обтурацию выводных протоков, что проявляется в увеличении зон деструкции и воспалительных изменений. Использование предложенного доступа и биоматериала для каркасной пластики позволяет уменьшить число ранних послеоперационных осложнений в 1,9-5,3 раза и полностью предотвратить такие поздние осложнения, как косметический дефект и синдром Люси Фрей.
Результаты клинических испытаний биоматериала для каркасной пластики при закрытии дефектов ОСЖ позволили рекомендовать данный трансплантат с целью профилактики как ранних послеоперационных осложнений – формирование свища, так и поздних – синдром Люси Фрей.
При хирургическом лечении гигантских смешанных опухолей околоушных слюнных желёз при отсутствии поражения лицевого нерва и цитологической верификации процесса необходима щадящая тактика в отношении лицевого нерва.
В трудных случаях парафарингеальной и смешанной локализаций для удаления глоточной части опухоли необходимо производить временную двойную остеотомию нижней челюсти.
Литература
-
Экспериментальная аллопластика при частичной резекции околоушной слюнной железы / Р.Т. Нигматуллин, С.Н. Гайфуллин, С.В. Вырупаев [и др.] // Морфологические ведомости. - 2009. - Спец. вып.: Клиническая анатомия и экспериментальная хирургия в XXI веке: труды Всероссийской научной конференции, 14-16 октября 2009 г., Оренбург. - С. 215-217.
-
Первичная эстетическая реабилитация пациентов после субтотальной резекции околоушной слюнной железы / Э.Р. Мулдашев, С.В. Вырупаев, С.Н. Гайфуллин, Д.А. Щербаков. - Режим доступа: http://reg-surgery.ru/2_2009/articles_ru/2.html.
-
Способ МР-сканирования околоушной слюнной железы у человека в норме / Р.Т. Нигматуллин, Г.А. Кантюкова, С.Н. Гайфуллин, Д.А. Щербаков. - Режим доступа:
// http://reg-surgery.ru/2_2009/articles_ru/1.html. -
Первичная эстетическая реабилитация пациентов после субтотальной резекции околоушной слюнной железы / Э.Р. Мулдашев, С.В. Вырупаев, С.Н. Гайфуллин, Д.А. Щербаков // Актуальные вопросы стоматологии: материалы Всероссийской научно-практической конференции. - Уфа, 2009. - С. 148-149.
-
Способ визуализации околоушной слюнной железы у человека в норме с использованием МР-томографа / Р.Т. Нигматуллин, Г.А. Кантюкова, С.Н. Гайфуллин, Д.А. Щербаков // Актуальные вопросы стоматологии: материалы Всероссийской научно-практической конференции. - Уфа, 2009. - С. 152-154.
-
Мулдашев, Э.Р. Восстановительная хирургия околоушной слюнной железы в эксперименте / Э.Р. Мулдашев, С.Н. Гайфуллин, Д.А. Щербаков // Актуальные вопросы стоматологии: материалы Всероссийской научно-практической конференции. - Уфа, 2009. - С. 154-155.
к содержанию | опубликовать статью
ПРИМЕНЕНИЕ БИОМАТЕРИАЛА СТИМУЛЯТОР РЕГЕНЕРАЦИИ В ХИРУРГИЧЕСКОМ ЛЕЧЕНИИ ГРЫЖ ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКИ
Мусин Р. З.
ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Обоснована перспективность использования «Стимулятора регенерации» в хирургическом лечении грыж передней брюшной стенки. Определены показания к его применению. Разработаны и внедрены в клинике методика и способы применения инъекционной лекарственной формы аллотрансплантатов (ИЛФА) при пластике грыж различных локализаций, которые существенно не усложняют оперативное вмешательство, не увеличивают время его выполнения, не отягощают течение раннего послеоперационного периода.
Актуальность
Многочисленные статистические данные, представленные отечественными и зарубежными авторами, свидетельствуют о том, что грыжи, как причина плановых оперативных вмешательств, занимают одно из ведущих мест и представляют собой актуальную проблему современной хирургии. Об этом свидетельствуют и частота послеоперационных осложнений, и количество рецидивов после оперативного вмешательства, составляющих от 15 до 40% и сохраняющаяся высокая послеоперационная летальность при ущемлениях - от 5 до 13% (Антропов Н.В., 1990; Салахов Х.С., 1989; Adloff M., 1987). В связи с этим проблема помощи при грыжах живота приобретает большое значение не только как медицинская, но и как социальная.
Существующие способы герниопластики не в полной мере удовлетворяют потребности хирургов в решении задач при лечении больных с данной патологией. Сообщения последних лет свидетельствуют о поиске новых методов герниопластики, что вполне объяснимо, так как очевиден факт неудовлетворенности результатами лечения грыж передней брюшной стенки. В настоящее время весьма убедительно доказаны преимущества операций с применением дополнительных пластических материалов при обширных грыжах живота перед традиционными способами, обоснованы их целесообразность и надежность (Андреев С.Д, 1993; Корнилаев П.Г., 1999; Kranich H., 1990).
Однако, несмотря на существование многочисленных пластических материалов (ауто-, алло-, ксенотрансплантатов, эксплантатов), в лечении грыж живота и в настоящий момент остаются не решенные проблемы. Так одной из причин плохих исходов грыжесечения являются патологические изменения тканей передней брюшной стенки в зоне вмешательства (атрофически-дегенеративные, рубцовые), снижение их прочностных свойств, регенераторного потенциала (Химичев В.Г., 1985; Тоскин К.Д., Жебровский В.В., 1990; Черенъко М.П., 1992). Поэтому, одним из перспективных направлений в лечении грыж является применение комбинированной трансплантации, позволяющей решать одновременно несколько задач: устранение дефицита собственных тканей передней брюшной стенки, профилактика инфекционных послеоперационных осложнений, воздействие на замедленную регенерацию тканей пациента. В этой связи представляет интерес «Стимулятор регенерации» - инъекционная лекарственная форма аллотрансплантатов серии «Аллоплант» (ИЛФА), Его выраженное активирующее влияние на тканевые репаративные процессы, морфологически доказанное на различных экспериментальных моделях и клинически, пролонгированное действие биологических компонентов за счет постепенной биодеградации матрикса, низкая иммуногенность, простота применения, длительные сроки хранения во многом предопределили цель и задачи настоящего исследования.
Целью настоящего исследования является улучшение результатов хирургического лечения грыж передней брюшной стенки путем применения биоматериала Аллоплант «Стимулятор регенерации».
Материалы и методы
Данная работа представляет собой клинико-экспериментальное исследование, в которой изучена возможность использования инъекционной лекарственной формы аллотрансплантатов серии Аллоплант (ИЛФА) при лечении больных грыжами передней брюшной стенки с целью оптимизации регенераторных процессов.
ИЛФА изготавливается путем многоэтапной физико-химической обработки. Химический анализ показывает, что ИЛФА является препаратом с преимущественным содержанием белка (82,6%), в том числе коллаген (76,4%). В состав неколлагеновых белков (6,2%) входят вещества, экстрагируемые из матрикса, наиболее важными из которых являются гликозаминогликаны (Хасанов Р.А., 2000). При исследовании биологических свойств ИЛФА на различных экспериментальных моделях было выявлено, что она не проявляет заметных токсических и антигенных свойств, обладает выраженной митогенной активностью по отношению к клеткам макрофагального и фибробластического звена, способностью к индукции синтеза последними интерферона, воздействуя, таким образом, на ключевые элементы регенерации тканей (Хасанов Р.А., 1999; Сафин И.А., 1999, Нартайлаков Н.А., 1999). ИЛФА представляет собой чрезвычайно легкий волокнистый порошок белого цвета со слегка желтоватым оттенком, без запаха. ИЛФА практически нерастворима в воде и органических растворителях, однако, обладает достаточно хорошей смачиваемостью, что обеспечивает легкость экстомпорального приготовления суспензий. Последние мы готовили путем смешивания порошка ИЛФА с дисперсной средой, которой являлся 0,5 % раствор новокаина. Используемая нами концентрация (60 мг/мл) обусловлена, с одной стороны, требованиями к физическим свойствам суспензии (хорошей стабильности, ресуспендируемости и проходимости через иглу № 0840), с другой, потребностью в максимальном стимулирующем эффекте.
Для обоснования разработанного способа лечения грыж передней брюшной стенки с применением «Стимулятора регенерации» нами проведены экспериментальные морфологические и физико-механические исследования на 40 собаках. У 4 животных изучали показатели прочностных свойств интактной передней брюшной стенки по описанной ниже методике. Экспериментальная герниопластика выполнена на 36 собаках. Обезболивание осуществляли путем комбинирования внутримышечного введения кетамина гидрохлорида (40 мг/кг) и местной анестезии 0,5% раствором новокаина.
Экспериментальные операции проводили по следующей методике: на передней брюшной стенке по срединной линии разрезали и отсепаровывали кожу вместе с подкожной клетчаткой и поверхностной фасцией, иссекали участок переднего и заднего листков влагалищ прямых мышц, самих мышц, брюшины размером 4x8 см. Дальнейший ход операции различался. В первой группе (12 собак) образовавшийся дефект ушивали с созданием продольной дубликатуры. У второй группы (12 собак) аналогичная операция дополнялась введением в зону пластики в 4-5 точках с обеих сторон на 1см от линии швов по 0,5-1мл ИЛФА в предложенной концентрации. В 3-ей группе (12 животных) зону пластики, после ушивания дефекта край в край, укрепляли полипропиленовым сетчатым эксплантатом, фиксированным поверх апоневроза, также в сочетании с введением в зону пластики ИЛФА. Кожу ушивали.
Животных выводили из опыта через 7, 14, 30, 90, 180 и 270 суток после операции. Для исследования забирали образцы передней брюшной стенки в виде блока. Освобожденные от кожи и подкожной клетчатки, они были подвергнуты физико-механическим испытаниям на разрывной машине ZM-40 и морфологическому исследованию. Исследования проводились в лаборатории Института химии Уфимского НЦ РАН. Все вышеперечисленные экспериментальные исследования проводились с соблюдением принципов гуманного отношения к животным.
Прочностные свойства тканей определялись по следующим измеряемым и вычисляемым показателям: предельная прочность (соотносительная продольная деформация (е), модуль упругости (Е).
Полученные результаты
Биомеханические показатели интактной брюшной стенки составили: предел прочности 4,7 ± 0,5х106н/м2, относительное удлинение - 0,2, модуль упругости 23,5 ± 1,4х106н/м2.
Исследования показали, что применение сетчатого полипропиленового трансплантата повышает надежность пластики, а использование ИЛФА статистически достоверно (р<0,05) сокращает сроки восстановления прочностных свойств брюшной стенки в послеоперационном периоде, по сравнению с контрольной группой. Так, через 6 месяцев прочностные показатели составляют 91,5% от исходных - при использовании ИЛФА, и 76,5% - при обычной герниопластике. Кроме того, в ранние сроки отмечаются более высокие прочностные показатели у животных третьей группы в сравнении со второй; к окончанию эксперимента достоверных отличий нет. Таким образом, с формированием собственного регенерата синтетический эксплантат утрачивает свою каркасную функцию, которая играет существенную роль в сроки до трех месяцев.
Морфологические исследования показали, что в области инъекции диспергированного материала активно развиваются процессы пролиферации волокнистой соединительной ткани. Сформированные при этом коллагеновые волокна имеют отчетливую продольную ориентацию. Клетки представлены активными фиброцитами и фибробластами на разных стадиях созревания. При сочетанном применении лоскутного трансплантата на фоне сходной морфологической картины следует отметить преобладание в зоне, окружающей полипропиленовый имплантат, клеток фибробластического звена, прорастание синтетической ткани собственными волоконными структурами, сформированными кровеносными сосудами. В материале контрольной группы в те же сроки определялись пролиферативные процессы, однако, менее выраженные: волокна в большинстве своем незрелые, расположены хаотично, значительное преобладание в формирующейся ткани клеточного звена.
Через три месяца указанные процессы прогрессивно нарастали. Увеличивался объем регенерата, который формировался в зоне пластики. Наряду с процессом резорбции части существующих коллагеновых волокон, определялись обширные зоны пролиферации клеток и формирования новых структур, в соответствии с функциональными нагрузками, предъявляемыми регенерату. Архитектоника волокнистых пучков характерна для сухожилия, но между волокнами определялось много фибробластов и кровеносных сосудов, что указывает на недостаточную зрелость регенерата. Результаты исследования образцов, взятых у животных контрольной группы, свидетельствуют о существенном отставании процессов восстановления: пространственная организация не упорядочена, волоконные структуры тонкие, незрелые, большое количество фибробластов низкой степени дифференцировки.
В полной мере процессы регенерации соединительной ткани разворачиваются через 6 месяцев и более после пластики. В этот срок регенерат был представлен достаточно зрелой соединительной тканью с правильной ориентацией коллагеновых волокон, хорошей васкуляризацией, по ходу коллагеновых волокон обнаруживалось небольшое количество фибробластов, а концентрация макрофагов уменьшилась по сравнению с предыдущими сроками.
При протезирующей герниопластике полипропиленовый лоскут входил в состав регенерата, с многослойным расположением пучков коллагеновых волокон, в толще которого и определяются нити эксплантата без выраженных воспалительных изменений вокруг. В аналогичные сроки у животных, оперированных без применения ИЛФА, в гистологических срезах определялась грубая рубцовая ткань с хаотичным расположением коллагеновых волокон, процессы дифференцировки и пространственной перестройки которой еще не завершены. По результатам экспериментального исследования можно сделать выводы:
-
При введении в зону герниопластики ИЛФА полностью резорбируется. Её компоненты, активируя пролиферацию фибробластов оказывают выраженное стимулирующее влияние на процессы регенерации в области послеоперационного рубца.
-
ИЛФА обладает низкой реактогенностью, не вызывая в тканях выраженных воспалительных явлений;
-
Применение "Стимулятора регенерации" при пластике дефектов передней брюшной стенки способствует формированию соединительнотканного сращения, способного эффективно противодействовать внутрибрюшному давлению. Причем, восстановление прочностных свойств передней брюшной стенки в этом случае происходит в более короткие сроки по сравнению с контролем.
-
Сформированный регенерат в поздние сроки приобретает черты пространственно оформленной структуры, что более выражено при использовании комбинированной пластики (в сочетании с сетчатым протезом).
В обоих случаях зона пластики по прочности удовлетворяла предъявляемым нагрузкам.
Таким образом, использование ИЛФА при пластике грыж передней брюшной стенки было экспериментально обосновано.
Следующим этапом была проведена апробация данной технологии в клинике. Необходимо отметить, что у всех исследованных больных послеоперационные вентральные грыжи были срединной локализации. Удельная доля этих больных, труднее поддающихся оперативной коррекции, больше в основной группе, по сравнению с контрольной. Отмечается существенное преобладание сложных форм грыж в основной группе, что имеет большое значение при оценке результатов лечения. Грыжи были больших и гигантских размеров, при этом доля таких пациентов в основной группе несколько больше, чем в контрольной (26,9% и 20,4% соответственно). У исследованных больных имелись хронические сопутствующие заболевания. Следует отметить преобладание в основной группе, по сравнению с контрольной, технически более сложных вмешательств: по Постемскому, трансплантационной герниопластики.
При анализе ближайших послеоперационных результатов в контрольной группе больных выявлено 29 (17,2%) осложнений в области послеоперационной раны: инфильтраты в 20 случаях, у 3 больных выявлены нагноения послеоперационных ран, у 6 больных отмечалась лимфорея. Более благоприятные ближайшие исходы операции наблюдались у больных основной группы: только в одном случае (1,1%) отмечалась длительная лимфорея, инфильтрат образовался у 5 (5,5%) больных, нагноений послеоперационной раны не отмечалось. Каких-либо отклонений от обычной клинической картины после грыжесечения, связанных с применением ИЛФА, не наблюдалось.
Рецидива заболевания в течение первого месяца после операции выявлено не было. Отдаленные результаты изучены у 81 (87,1%) больного основной группы и 155 пациентов (83,3%) - контрольной, в сроки от 1 до 2 лет. Результаты характеризовались по трехбалльной шкале на основе объективных критериев (частота рецидивов, восстановление трудоспособности) и субъективной оценки качества жизни пациентами:
-
хороший - жалоб не предъявляет, рецидива грыжи нет, трудоспособность восстановлена полностью (соответственно возрасту), необходимости в амбулаторном наблюдении, медикаментозном лечении нет;
-
удовлетворительный - жалобы на кратковременные периодические боли в оперированной области, диспепсические расстройства, требующие симптоматической терапии, рецидива грыжи нет, трудоспособность сохранена, больной находится на диспансерном учете у хирурга;
-
неудовлетворительный - жалобы на частые резко выраженные боли в зоне вмешательства, значительные диспепсические расстройства, что делает необходимой систематическую медикаментозную терапию, отмечен рецидив заболевания, трудоспособность снижена, либо утрачена, больной лечится амбулаторно.
Существенная разница выявлена при их сопоставлении. В основной группе хорошие результаты получены у 67 больных (82,7% от числа обследованных), удовлетворительные у 13 (16,1%), не удовлетворительные у 1 больного (1,2%). В контрольной группе хороших результатов - 96 (61,9%), удовлетворительных - 37 (23,9%), не удовлетворительных - 22 (14,2%). При анализе случаев рецидивирования (у 22 (14,2%) больных контрольной группы и 1 (1,2%) - основной группы) установлено, что они возникли, во-первых, неадекватным выбором способа операции, без учета степени изменений мышечно-апоневротических тканей брюшной стенки и факторов, влияющих на регенерацию и формирование послеоперационного рубца; во-вторых, вследствие нагноения послеоперационной раны; в третьих, вследствие тяжелой физической работы в раннем послеоперационном периоде.
Приведенные данные свидетельствуют, что герниопластика, выполненная одним из традиционных способов, не всегда приводит к желаемым результатам. Добиться более благоприятных исходов позволяет применение при оперативном лечении ИЛФА. Таким образом, анализ экспериментальных исследований и результатов клинического применения показал, что ИЛФА «Стимулятор регенерации» с успехом может применяться в сочетании с хирургическим лечением больных грыжами передней брюшной стенки, расширяя возможности хирурга в оказании помощи наиболее сложной группе пациентов.
Заключение и практические рекомендации
После введения в зону герниопластики ИЛФА, последняя постепенно полностью рассасывается, продукты ее распада путем активации лимфоцитов, пролиферативной и синтетической активности фибробластов, приводят к более быстрому формированию в послеоперационном периоде эластичного функционально-адекватного регенерата, представленного плотной оформленной соединительной тканью, что сопровождается укорочением сроков восстановления прочностных свойств передней брюшной стенки.
Показаниями к применению при герниопластике ИЛФА являются грыжи передней брюшной стенки любых размеров, при наличии следующих факторов:
1) пожилой и старческий возраст пациентов;
2) наличие тяжелых, длительно текущих сопутствующих заболеваний и состояний, снижающих регенераторный потенциал организма больного;
3) грубые рубцовые изменения тканей передней брюшной стенки (рецидивные, послеоперационные грыжи);
4) использование при герниопластике дополнительных пластических материалов (синтетических, ауто-, аллотрансплантатов).
Разработанные в клинике способы применения ИЛФА при операциях по поводу различных видов грыж передней брюшной стенки технически легко выполнимы, не увеличивают продолжительность вмешательства, не отягощают течение раннего послеоперационного периода и представляют собой эффективное средство профилактики рецидивов.
Использование «Стимулятора регенерации» в хирургическом лечении больных грыжами передней брюшной стенки позволило существенно снизить частоту рецидивов заболевания с 14,2%- в контрольной группе до 1,2% - в группе с применением ИЛФА, добиться более благоприятных исходов. На этапе предоперационного обследования пациентов и во время хирургического вмешательства необходимо более обоснованно подходить к оценке регенераторного статуса организма больного, в частности тканей передней брюшной стенки. При наличии показаний - целесообразно применение разработанного способа стимулирования местных регенераторных процессов с использованием ИЛФА «Стимулятор регенерации» при пластике различных видов грыж передней брюшной стенки.
Оправдано использование предложенного способа при завершении плановых и экстренных оперативных вмешательств на органах брюшной полости, как средства эффективной профилактики послеоперационных вентральных грыж, у больных с повышенным риском их образования. Разработанный способ, отличаясь простотой, применим как в крупных клиниках, так и в общехирургических отделениях районных больниц.
Литература
-
Опыт применения "Стимулятора регенерации" - инъекционной лекарственной формы аллотрансплантатов серии "Аллоплант"- в лечении вентральных грыж. //Тезисы докл. Республиканской молодежной научной конференции и 65-й Юбилейной научной конференции студентов и молодых ученых БГМУ "Вопросы теоретической и практической медицины".-Уфа, 2000.-Том 2.-С.47.
-
Час юга возникновения послеоперационных вентральных грыж в экстренной хирургии органов брюшной полости // Тезисы докл. Республиканской молодежной научной конференции и 65-й Юбилейной научной конференции студентов и молодых ученых БГМУ "Вопросы теоретической и практической медицины".-Уфа, 2000.-Том 2.-С. 49 (совместно с М.А. Нуртдиновым, В.О. Хановым, Р.А. Смыр).
-
Пути улучшения результатов хирургического лечения в абдоминальной хирургии // Тезисы докл. Республиканской молодежной научной конференции и 65-й Юбилейной научной конференции студентов и молодых ученых БГМУ "Вопросы теоретической и практической медицины".-Уфа, 2000.-Том 2.-С.56 (совместно с М.В. Тимербулатовым, А.М. Шумкиным, М.М. Башаровым, Р.А. Смыр, Аль Хамад Нахед, А.Р. Шамсутдиновым, О.М. Павловой, И.М. Каримовым).
-
Опыт лапароскопической герниопластики. // Тезисы докл. Республиканской молодежной научной конференции и 65-й Юбилейной научной конференции студентов и молодых ученых БГМУ "Вопросы теоретической и практической медицины".-Уфа, 2000.-Том 2.-С.60 (совместно с В.О. Хановым, М.А. Нуртдиновым, Р.Р. Богдановым, М.В. Тимербулатовым, М.М. Башаровым, Р.А. Смыр, Аль Хамад Нахед).
-
Применение «Стимулятора регенерации» - инъекционной лекарственной формы аллотрансплантатов серии «Аллоплант» - в хирургическом лечении вентральных грыж.// Тезисы докл. Научно- практической конференции «Новые медицинские технологии в хирургической и терапевтической практике в Республике Башкортостан». 3дравоохранение Башкортостана.-2000.-№4.-СЛЗ (совместно с О.В. Галимовым, М.А. Нуртдиновым).
-
Лапароскопическое лечение паховых грыж.// Тезисы докл. Научно-практической конференции «Новые медицинские технологии в хирургической и терапевтической практике в Республике Башкортостан». Здравоохранение Башкортостана.-2000.-№4.-С. 14 (совместно с О.В. Галимовым, Е.И. Сендеровичем, Ю.Н. Гололобовым).
-
Аутодермопластика в хирургическом лечении послеоперационных вентральных грыж.// Тезисы докл. научно- практической конференции «Новые медицинские технологии в хирургической и терапевтической практике в Республике Башкортостан». Здравоохранение Башкортостана.-2000.-№4.-С. 15 (совместно с О.В. Галимовым, Е.И. Сендеровичем, Э.М. Сакаевым, М.В. Тимербулатовым, В.О. Хановым).
-
Применение «Стимулятора регенерации» в хирургическом лечении вентральных грыж.// Материалы 2 Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины». Москва.-2001.-С.34.
-
Способ стимулирования местных регенераторных процессов при лапароскопической протезирующей герниопластике паховых грыж.// Удостоверение на рационализаторское предложение №2203 от 20.04.00, выданное Башгосмедуниверситетом.
-
Способ стимулирования регенераторных процессов при лапароскопической геринопластике паховых грыж местными тканями.// Удостоверение на рационализаторское предложение № 2204 от 20.04.00, выданное Башгосмедуниверситетом.
-
Способ стимулирования местных регенераторных процессов при протезирующей герниопластике вентральных грыж.// Удостоверение на рационализаторское предложение № 2205 от 20.04.00, выданное Башгосмедуниверситетом.
-
Способ стимулирования регенераторных процессов при герниопластике вентральных грыж местными тканями.// Удостоверение на рационализаторское предложение № 2207 от 20.04.00, выданное Башгосмедуниверситетом.
-
Способ стимулирования регенераторных процессов при герниопластике паховых грыж местными тканями.// Удостоверение на рационализаторское предложение №2208 от 20.04.00, выданное Башгосмедуниверситетом.
-
Способ стимулирования регенераторных процессов при протезирующей герниопластике паховых грыж.// Удостоверение на рационализаторское предложение № 2209 от 20.04.00, выданное Башгосмедуниверситетом.
к содержанию | опубликовать статью
МИОПЛАСТИЧЕСКАЯ РЕИННЕРВАЦИЯ ПАРАЛИЗОВАННЫХ МИМИЧЕСКИХ МОРЩИН БИОМАТЕРИАЛАМИ СЕРИИ АЛЛОПЛАНТ
Хамитов Э. Т.
ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию», г. Уфа ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» , г. Уфа
Автором в эксперименте изучена возможность миопластической реиннервации парализованных мимических мышц с помощью разработанного нами нового пересадочного биоматериала Аллоплант - «Стимулятора нейро- и васкулогенеза с ингибитором рубца». Экспериментально исследован и предложен в практическую хирургию «Биоматериал для статического подвешивания и фиксации органов и тканей».
Актуальность
Развитие параличей мимических мышц связано с поражением лицевого нерва, заболеваемость которого в различных регионах мира составляет 16—25 случаев на 100 тысяч населения (П.М. Альперович и др., 1978; 1980, 1981; А.Б. Гринштейн, 1980; М.А. Фарбер, Ф.М. Фарбер, 1991). Среди черепно-мозговых нервов поражение лицевого нерва занимает первое, а среди заболеваний периферической нервной системы в целом - второе место. По данным различных авторов выздоровление и значительное улучшение наступает только у 60—75% больных (В. О. Калина, М. А. Шустер, 1970; В. А. Карлов, 1991). У каждого четвертого-пятого пациента развивается контрактура мимических мышц (Я.Б. Юдельсон, 1978, 1980; М.А. Фарбер, 1984, 1991; Г.А. Иваничев, 1990).
Заболевание лицевого нерва, независимо от этиологии заболевания, всегда приводит к парезам или параличам мимических мышц, сильно обезображивая форму лица. Основные симптомы поражения мимических мышц связаны, главным образом, с парезом или параличей щечной мышцы и круговой мышцей рта. При этом опускается угол рта, щека во время разговора «парусит», изменяется речь, из опущенного угла рта вытекает слюна. Во время еды больной вынужден периодически извлекать пальцами пищу из щечного кармана, т. к. перерастяжение мягких тканей щеки приводит к скоплению в ней части пищи. Кроме того, при заболевании лицевого нерва возможно развитие гипофункции слезной, поднижнечелюстной и подъязычно-слюнной желез, а также нарушения слуха, зрения, вкуса (В. А. Карлов, 1991; М. А. Фарбер, Ф. М. Фарбер, 1991).
Указанные осложнения могут потребовать оперативного вмешательства с целью ревизии нерва, пластики его или пластического исправления дефекта.
Сложность хирургического лечения этого нерва связана с тем, что изолированное поражение его ветвей на лице встречается крайне редко, чаще нерв повреждается внутри височной кости или имеет место его внутричерепное поражение (В.О. Калина, М.А. Шустер, 1970).
Лечение внутричерепных поражений лицевого нерва малоэффективно, поскольку в этой анатомической области нерв труднодоступен и особенно уязвим из-за отсутствия защитной эпиневральной оболочки.
На наш взгляд, наиболее интересным и перспективным представляется метод миопластики. При этом, существующие методы мышечной пластики, направленные на подшивание к парализованным мимическим мышцам мышечных лоскутов на ножках, выкроенных из собственно-жевательной или височной мышцы (иннервируются 3 ветвью тройничного нерва), не обеспечивают полноценного функционального восстановления мимических мышц. Это связано с тем, что в зоне контакта мышц, почти одновременно с активным прорастанием сосудов и нервов в парализованную мышцу (обладающей, как известно, притягивающим нейротропным действием), развиваются процессы формирования плотного соединительнотканного регенерата (т. н. «межмышечного рубца»), который по мере своего формирования (с 7—10 дня) сдавливает проходящие через него сосуды и нервные аксоны, что, в конечном счете, делает невозможным полноценную реиннервацию парализованных мимических мышц. При этом пучки жевательных мышц играют лишь роль динамического подвешивателя для перерастянутых мимических мышц. Активного, самостоятельного сокращения мимических мышц лица не происходит, что, конечно, ухудшает результаты операции, особенно в покое, когда отсутствует сокращение жевательных мышц.
На наш взгляд, миопластику мимических мышц необходимо обязательно сочетать со стойким статическим подвешиванием мягких тканей лица. Это связано с тем, что косметический эффект от реиннервации, если этого удастся добиться миопластическим путем, будет проявляться только при активном сокращении жевательными мышцами. В покое же, без дополнительного статического подвешивания опущенных мягких тканей лица, косметический дефект будет отчетливо выражен. При этом мы допускаем, что в отдаленном послеоперационном периоде, путем длительной специальной тренировки, возможно добиться раздельного функционирования мышечного лоскута жевательной мышцы без осуществления активных жевательных движений.
В целом, в изученной нами литературе, недостаточно материалов об экспериментальном и клиническом применении миопластики с целью реиннервации парализованных мимических мышц, сведения о результатах операций носят весьма противоречивый или неопределенный характер.
Основной целью данной работы явилась разработка и экспериментальное обоснование нового способа комбинированного хирургического лечения параличей мимических мышц - «Миопластическая реиннервация со стойким статическим подвешиванием мягких тканей лица биоматериалами серии Аллоплант.
Материалы и методы исследования
Для решения поставленных задач нами были в эксперименте изучены: лицевой нерв, щечная и жевательная мышцы - в условиях нормы, денервации и при миопластике (в т.ч. биоматериалами серии Аллоплант. При этом применялись - препаровка, гистологические, гистохимические и электрофизиологические методы исследования.
Кроме того, были проведены физико-механические исследования сухожилий подошвенных мышц трупов человека.
Возможность моделирования денервационного процесса и изучения реиннервации мимических мышц в условиях опыта на животных обусловлена результатами сравнительно-анатомических исследований, показавших, что морфо-функциональная организация системы лицевой нерв - мимические мышцы у различных представителей класса млекопитающих, в том числе и человека, основана на общих принципах (А.Т. Олешкевич, 1965; 3.А. Скурданова, 1966; Л.С. Марченкова, 1972 и др.).
Нами была избрана экспериментальная модель «лицевой нерв — мимические мышцы» кролика, которая удобна тем, что лицевой нерв кролика имеет небольшую протяженность и может быть изучен на всем протяжении его экстракраниального отдела; мимические мышцы отличаются малыми размерами, что дает возможность исследовать их тотально; в мимических мышцах отсутствуют зоны, полностью лишенные иннервации. При этом нами учитывался ряд морфологических особенностей, характерных для мимических мышц кролика (Л.С. Марченкова, 1972):
1) сложный ход внутримышечных ветвей лицевого нерва;
2) большая насыщенность мимических мышц кролика двигательными нервными окончаниями;
3) высокая активность ацетилхолинэстеразы во внутримышечных нервных образованиях.
Для фиксации животных, проведения оперативного вмешательства на лицевом нерве и лицевых мышцах, а также для изучения их функционального состояния, нами было разработано и сконструировано оригинальное устройство (рац. предложение № 1516 от 10.01.1994 г.).
Рассечение мягких тканей производилось с помощью разработанного нами режущего инструмента (рац. предложение № 1119 от 3.05.1988 г.), а удаление жидкого содержимого операционной раны с помощью электроотсоса с оригинальным сменным патрубком (рац. предложение № 1120 от 3.05.1988г.).
Экспериментальная, часть работы включает итоги 520 опытов, поставленных на 98 кроликах породы шиншилла с массой тела 2,5—3,5 кг.
Всего проведено 3 серии опытов.
Опыты первой серии выполнены на 28 кроликах, которым была произведена перерезка правых лицевых нервов. Таким образом, в различные сроки после травмы изучались морфо-функциональные особенности денервационного процесса в лицевых нервах и щечных мышцах. Контролем в этой серии служила интактная левая сторона.
На кроликах 2-й серии (34 кролика), одномоментно, после перерезки правого лицевого нерва проводилась миопластическая операция. При этом, мышечная ножка, выкроенная из правой собственно-жевательной мышцы, подшивалась кетгутовыми швами к денервированной щечной мышце.
На кроликах 3-ей серии (36 животных) выполнялась операция, идентичная операциям, проводимым на кроликах 2-ой серии, но при этом применялись аллогенные биоматериалы серии Аллоплант.
Для создания модели паралича мимических мышц у всех кроликов, во всех трех сериях, в асептических условиях было произведено пересечение ствола правого лицевого нерва. Разрез кожи проводился от уха по направлению к углу нижней челюсти. Околоушная железа несколько выделялась и отодвигалась кпереди. Лицевой нерв тщательно выделялся у шило-сосцевидного отверстия. Для предупреждения (или резкого замедления) прорастания лицевого нерва, под него подводилась и накладывалась Шелковая раздавливающая" лигатура.
Дополнительно, проксимальнее лигатуры, внутриствольно вводилось 2 мл спирт-новокаиновой смеси (1 мл 2% р-ра новокаина + 1 мл 96% спирта). После этого, дистальнее лигатуры, нерв перерезался. Рана ушивалась послойно.
Животных во всех сериях выводили из эксперимента на 5—10; 20—35; 60; 90; 180 сутки. В каждой группе было 5— 8 кроликов. Все серии опытов были проведены в дневное время суток в осенне-зимний период. Во всех сериях было равное количество самцов и самок, животные имели приблизительно один возраст (8—10 месяцев) и содержались в одинаковых условиях.
У животных первой серии, до операции и в различные сроки послеоперационного периода, с обеих сторон изучалось функциональное состояние лицевого нерва и щечной мышцы. Для этого определяли пороги возбудимости на постоянный и прямоугольный импульсный (1 мсек, 100 гц) ток, моторную хронаксию, уровень физиологической лабильности, порог гальванического тетануса, строили кривые напряжение-время (сила-длительность) щечных мышц.
Для проведения указанных исследований использовались приборы ЭНС-01 и ИСЭ-1.
После завершения физиологических опытов, в разные сроки животных забивали и проводили морфологическое изучение щечных мышц с обеих сторон (денервированных правых и контрольных левых). Материал фиксировали в 12% нейтральном формалине. Применяли следующие гистологические методы обработки: окраска гематоксилином, гематоксилин-эозином, по Ван-Гизону; импрегнация по Малори и Гросс-Бильшовскому.
Часть материалов было подвергнуто гистологическому исследованию — выявлению активности ацетилхолипэсте-разы по Гомори с последующим получением изолированных мышечных волокон.
Для получения изолированных мышечных волокон, мышцы (после выявления активности ацетилхолинэстеразы) подвергали щелочной диссоциации 50% раствором КОН и импрегнировали по Бодиану.
По мере выведения животных 1-ой серии опытов, от них производился забор некоторых тканей (сухожилия конечностей, фасции, реберные хрящи, мозговая ткань, твердая мозговая оболочка), из которых лабораторией по производству аллотрансплантатов Всероссийского центра глазной и пластической хирургии в соответствии с ТУ 42-2-537-87 изготовлялись пересадочные биоматериалы серии Аллоплант. Два вида этих биоматериалов—шовный сухожильный биоматериал и «Стимулятор нейро- и васкулогенеза с ингибитором рубца» использовались при миопластике на кроликах 3-ей серии.
Исследования физико-механических свойств сухожилий подошвенных мышц человека — предел прочности и относительное удлинение, проводились с помощью разрывной машины ZM-40, снабженной динамометрическим датчиком и ленточным самописцем при расстоянии между зажимами 50 мм и скорости приложения нагрузки 30 мм/мин. Исходный диаметр всех исследуемых нитей измерялся бесконтактным методом на приборе «Alloscan» с точностью 0,01 мм.
Изучение прочностных характеристик нитей из сухожилий подошвенных мышц человека, для решения вопроса об их пригодности к статическому подвешиванию и наложению швов, проводилось растяжением этих сухожилий до и после гамма-стерилизации. Дополнительно к таким основным характеристикам, как предел прочности и относительное удлинение, были изучены прочность исходной нити в узле и прочность влажной нити. Прочностные характеристики изучались после гамма-стерилизации в дозе 25 КГрей для сухих нитей и нитей, подвергнутых гидратации в физиологическом растворе в течение 30 минут.
Забор сухожилий производился у трупов скоропостижно скончавшихся людей не позднее 24 часов после смерти. Возраст погибших составлял 20—50 лет; всего от 32 трупов произведен забор 64 сухожилий подошвенных мышц.
Исследуемые образцы были разделены на равные группы сухих и влажных сухожилий, по 32 в каждой. В каждой группе было равное количество сухожилий мужчин и женщин (по 16 в каждой), принадлежащих людям примерно одной возрастной категории.
Разрывная нагрузка (F) определялась по максимальному показанию динамометра в момент разрыва нити в зажиме.
Относительное удлинение ? определялось по формуле
? = ?L / Lo
где: Lo—длина образца (расстояние между зажимами) равная 50 мм; ?L - удлинение нити в момент разрыва, определяемое по показаниям ленточного самописца в миллиметрах. Предел прочности Р определялся по формуле: Р = F / S, где: S - площадь поперечного сечения нити в мм 2.
Прочность нити в узле определялась аналогично прочности на разрыв. Отличие заключалось в том, что нить предварительно завязывалась в простой однопетельный узел, который размещался посередине между зажимами».
Контрольная группа включала 36 нитей кетгута и 32 ксеногенные нити хвостовых сухожилий крысы, на которых проводились аналогичные исследования.
Особенности техники миопластики парализованных щечных мышц в эксперименте
Опыты на кроликах 2-ой и 3-ей серии заключались, как отмечалось выше, в одномоментной операции, где денервация мимической мускулатуры сочеталась с попыткой мио-пластическим методом добиться предупреждения или уменьшения патологических морфофункциональных изменений в денервированной мимической мускулатуре. Для этого, сразу после перерезки правого лицевого нерва, из собственно-жевательной мышцы, через всю ее толщу, выкраивался мышечный лоскут на сосудисто-нервной ножке, который подшивался к денервированной щечной мышце.
Наши усилия были направлены на восстановление функции щечной мышцы по следующим причинам:
- щечная мышца — важнейшая мимическая мышца нижнего этажа лица, которая всегда страдает как при центральных, так и при периферических параличах лицевого нерва (мимические мышцы верхнего этажа лица при центральных параличах не страдают);
- поражение этой мышцы вызывает самые тяжелые функциональные нарушения (нарушение сфинктерной функции околоушной слюнной железы; изменение речи; формирование пищевого комка не над корнем языка, а в защечном кармане и др.);
- в дистальный конец этой мышцы вплетаются почти все мимические мышцы нижнего этажа лица, поэтому, в случае реиннервации щечной мышцы, можно ожидать восстановления и этих мышц;
- щечная мышца наиболее удобна для пластики, поскольку анатомически она ближе всего прилежит к собственно-жевательной мышце, не срастается с кожей, имеет большую площадь поверхности.
Технически и в опытах 2-ой, и в опытах 3-ей серии выкраивание лоскутов и наложение швов производилось совершенно одинаково. При этом, в обеих сериях выполнялись следующие обязательные условия:
1) выкраивание мышечных лоскутов производилось с учетом топографии внемышечных и внутримышечных нервно-сосудистых образований;
2) после выкраивания ножки производился тщательный гемостаз;
3) для предупреждения сдавления сосудов и нервов лоскута в поперечном направлении—шовный материал накладывался, по возможности, вдоль мышечного лоскута, на его дистальную часть, и только в виде одиночных узловатых швов;
4) щечная мышца в месте ее контакта с мышечным лоскутом обязательно «освежалась»;
5) вначале прошивался лоскут жевательной мышцы, дальнейшее ее подшивание к щечной мышце контролировалось таким образом, чтобы после затягивания узлов не было сильного натяжения мобилизованного мышечного лоскута.
Топография вне- и внутримышечных нервно-сосудистых образований жевательных мышц человека и некоторых животных наиболее полно изучено А. А. Миронцевой (1955). Основные выводы ее работы в отношении собственно-жевательной мышцы кролика:
- ворота вхождения нерва и артерий не совпадают. Нерв вступает в мышцу, примерно, на середине протяжения скулового края. Места вхождения артерий располагаются во многих местах мышцы, а именно: вдоль каудального края вступает артерия от поверхностной височной артерии, вдоль вентрального края—мышечные ветви от наружной челюстной артерии, и, наконец, вдоль всего скулового края мышцы вступают последовательно г. г. musculares masseterici от поперечной артерии лица;
- внутримышечное ветвление нерва не соответствует внутримышечному ходу артерий, хотя тип ветвления как нервов, так и артерий—рассыпной;
- внутримышечные нервные связи при макро-микро-скопическом исследовании не обнаруживаются.
Среди мелких внутримышечных артериальных ветвей имеется довольно большое количество анастомозов, которые образуют мелкопетлистую сеть.
Опираясь на эти выводы, мы сочли возможным выкраивание полноценного мышечного лоскута следующим образом.
Животное фиксировалось в станке, с правой половины морды кролика срезалась шерсть, кожа обрабатывалась 1% р-ром бриллиантового зеленого.
На 1-ом этапе операции перерезался правый лицевой нерв (метод денервации описан выше).
На II-ом этапе—под м/о Змл 0,25% р-ра новокаина, на 2—3 мм кпереди от переднего края правой собственно-жевательной мышцы, производился вертикальный разрез кожи и поверхностной фасции.
Очень осторожно, чтобы не повредить лицевую артерию, идущую параллельно переднему краю собственно-жевательной мышцы, вскрывалась собственная фасция этой мышцы. При этом разрез, длиной 3— 3,5 см, проводился по желобоватому зонду—на 1—2 мм кзади и параллельно переднему краю собственно-жевательной мышцы. В передний край мышцы вводилось 1,0—1,5 мл 0,25% р-ра новокаина, собственная фасция отодвигалась кзади. Разрез собственно-жевательной мышцы начинался на 8—10 мм ниже верхнего ее края и проводился вниз па 10— 12 мм кзади и параллельно переднему краю мышцы.
Дальнейшее формирование мышечного лоскута на ножке производили острыми ножницами, отсепаровывая передний край мышцы от нижней челюсти. Тщательно производили гемостаз, после чего осторожно разворачивали мышечный лоскут кпереди и прикладывали его к заднему краю щечной мышцы, определяя будущую зону контакта мышц. В этой зоне «освежали» поверхность щечной мышцы, останавливали кровотечение, после чего прошивали края мышечного лоскута 3-4 шовными нитями (у кроликов 2-ой серии—кетгутом, у кроликов 3-ей серии сухожильными шовными нитями серии Аллоплант).
Окончательно останавливали кровотечения и, в экспериментах на кроликах 3-ей серии, посыпали на зону межмышечного контакта щечной мышцы биоматериал серии Аллоплант «Стимулятор нейро- и васкулогенеза с ингибитором рубца» Нижними свободными концами нитей, чуть кнутри от края межмышечного контакта, прошивали щечную мышцу. Завязывали одиночные узловатые швы таким образом, чтобы после затягивания нитей не было сильного давления на края мышц.
На поверхность собственно-жевательной мышцы, в то место, откуда был выкроен лоскут, дополнительно засыпали «Стимулятор нейро- и васкулогенеза с ингибитором рубца». Тонким капроном восстанавливали целостность собственной фасции жевательной мышцы. Накладывание непрерывного шва на фасцию начинали с ее нижней части и заканчивали у нижнего края лоскута жевательной мышцы.
Далее послойно ушивали поверхностную фасцию и кожу. Края кожной раны смазывали р-ром бриллиантового зеленого, накладывали давящую марлевую повязку.
Животное оставляли в станке на 16—18 часов, после чего удаляли повязку, повторно смазывали кожу зеленкой и выпускали в клетку.
Электрофизиологические исследования начинали с 10 дня после миопластики. Забор мышц для гистологического и гистохимического исследований проводился после выведения подопытных животных из эксперимента с помощью 10% раствора тиопентала натрия в дозировке 100—150 мг па 1 кг веса животного.
Результаты собственных исследований
Проведенные гистологические и гистохимические исследования щечных мышц дали следующие результаты. Опыты на животных 1-й серии, где изучались морфологические изменения в щечных мышцах в различные сроки после перерезки лицевого нерва, показали, что эти изменения подчиняются общим закономерностям денервационного процесса, характерным для всей скелетной мускулатуры. Уже в ранние сроки после денервации развиваются атрофические и дистрофические изменения мышечной ткани — происходит истончение мышечных волокон, увеличение мышечных ядер, сглаживается рисунок поперечной исчерченности. Постепенно развивается процесс распада мышечных волокон, саркоплазма во многих мышечных волокнах и целых пучках гомо-генезириуется. На месте бывших мышечных волоком начинают обнаруживаться скопления жировых клеток. Усиленно разрастается соединительная ткань, замещая все большие участки мышцы.
Через 180 дней после денервации описываемые изменения захватывают большую часть мышечной ткани и проявляются в значительно более резкой форме. Мышечные волокна повсеместно резко истончены и в большинстве несколько извиты и деформированы, рисунок поперечной исчерченности резко сглажен. Во всех отделах мышцы встречаются набухшие и гомогенизированные мышечные волокна и пучки. Кроме того, имеются обширные участки с усиленно разросшейся соединительной тканью, где мышечная ткань представлена небольшими островками. Вполне развитая картина миофиброза дополняется скоплениями жировых клеток.
Основные результаты, полученные на кроликах II-й серии опыта, где была выполнена денервация с одновременной мышечной пластикой сводится к следующему.
Уже к 20-му дню после операции и мышечной ножке жевательной мышцы обнаруживаются явления, свидетельствующие о начале процесса усиленной регенерации нервных элементов. Появляются одиночные бледно-окрашенные топкие, сильно извитые вновь образованные нервные волокна, ответвляющиеся от крупных и мелких первых пучков и значительно отличающиеся по внешнему виду от старых нервных волокон.
Новообразованные нервные волокна и отдельные мелкие нервные пучки тройничного нерва идут в разных направлениях, сосредотачиваясь ближе к области сращения с денернированной щечной мышцей. Большинство одиночных нервных волокон доходит до пограничной зоны и теряется в ее пределах. Пограничная зона к этому сроку представляет из себя плотный соединительнотканный регенерат.
Следствием формирования этого межмышечного рубца явилось то, что ни на одних препаратах, выполненных из щечных мышц животных 2-й серии в различные сроки наблюдения, не было обнаружено вновь образованных нервных элементов тройничного нерва. Выявлялись лишь старые нервные пучки лицевого нерва, находящиеся в стадии далеко зашедшего вал-леровского перерождения. Вся морфологическая картина мышечной ткани денервированной мускулатуры свидетельствовала о наличии серьезных нарушений ее структуры, хотя темпы дегенеративных изменений были значительно снижены по сравнению с таковыми в мускулатуре животных 1-й серии, так морфологические изменения в денервированных щечных мышцах кроликов 2-й серии на 180 сутки опыта соответствуют изменениям в этих мышцах у кроликов 1-й серии на 90-е сутки после денервации.
Таким образом, наши исследования показали, что миопластика, выполненная на животных 2-й серии «классическим способом», т. е. путем подшивания лоскутов жевательной мышцы на ножке к денервированной щечной мышце, не приводит к реиннервации последней. При этом, подшитая мышечная ножка оказывает определенное трофическое влияние на депервированную мышцу, значительно замедляя темпы ее дегенерации.
Основные результаты, полученные на кроликах 3-ей серии, где денервация правой щечной мышцы сочеталась с одновременной мышечной пластикой биоматериалами серии Аллоплант, сводились к следующему.
До 30-х суток после операции состояние мышечной ткани щеки мало отличалось от денервированной щечной мышцы животных 2-ой серии.
Однако, уже на препаратах, выполненных на 35 сутки после миопластики, удалось проследить непосредственный переход из жевательной мышцы в депервированную щечную мускулатуру не только отдельных волоконец, но и целого пучка длинных, вновь образованных нервных волокон тройничного нерва.
Начиная с 60-х суток после миопластики биоматериалами Аллоплант в щечной мышце наблюдаются выраженные восстановительные процессы. При этом отдельные мышечные волокна на своих свободных концах образуют колбообразные утолщения — так называемые мышечные почки роста, которые являются главным показателем регенераторного восстановления мышц. К этому сроку в щечной мышце обнаруживается большое количество миелинсодержащих ветвящихся нервных пучков, пересекающих мышцу в различных направлениях и располагающихся главным образом в межуточной ткани. Наибольшая концентрация нервных элементов определяется в участках щечной мышцы, близких к месту межмышечного соприкосновения, хотя отдельные пучки и нервные волокна прослеживаются на значительном протяжении дистальных отделов этой мышцы.
К 90 суткам явления реиннервации и восстановительные процессы в щечной мускулатуре получают свое дальнейшее* развитие. В участках мышцы, прилегающих к месту пластики, обнаруживается густая сеть в виде сплетения, состоящего из нервных волокон различных размеров с преобладанием тонких и тончайших одиночных волокон. Из области межмышечного контакта в дистальном направлении идут хорошо сформированные пучки тонких нервных волокон, которые прослеживаются почти на всем протяжении щечной мышцы.
Отходящие от пучков и небольших новообразованных нервных стволиков отдельные нервные волокна чаще всего идут параллельно мышечным волокнам, образуют здесь нервные окончания, которые встречаются значительно чаще, и среди них начинают преобладать нервные окончания кустиковой формы. Обращает внимание и то, что распределение новообразованных нервных волокон и окончаний, концентрирующихся вначале в области межмышечного контакта и в близлежащих к нему участках денервированной мышцы, постепенно приобретает более равномерный характер, и к 3-м месяцам концентрации указанных элементов во всех отделах щечной мышцы более или менее выравнивается. При этом большая часть мышечных волокон находится в сравнительно хорошем состоянии. Несколько истонченные, они расположены ровными рядами, количество ядер в них лишь незначительно увеличено, поперечная исчерченность выражена хорошо.
К 180 суткам эксперимента форма и размеры мышечных волокон близки к нормальным — хорошо выражены поперечная исчерченность, количество ядер близко к норме, мышечные волокна хорошо васкуляризированы и на всем своем протяжении имеют нервные волокна, идущие параллельно мышечным волокнам и пучкам.
Гистохимические исследования, выполненные на кроликах всех трех серий и направленные на определение ацетил-холинэстеразной активности, показали, что процессы формирования функционально зрелых эффекторов Щечной мышцы происходят только у животных 111-й серии.
Первые единичные случаи формирования эффекторов мы отмечали, начиная с 60-х суток эксперимента. К 90-м суткам этот процесс принимал массовый характер, а к 180 суткам наших исследований носил уже законченный вид.
Проведенные электрофизиологические исследования показали, что порог прямой возбудимости щечных мышц в опытах на кроликах I и II серии прогрессивно увеличивался, хотя темпы этого роста в опытах II серии заметно отставали от такового в опытах на кроликах I серии. Порог прямой возбудимости щечных мышц у кроликов III серии, где была выполнена миопластика с применением биоматериала серии Аллоплант, в послеоперационном периоде снижался и к 180 суткам опыта приблизился к норме.
Таким образом, проведенные морфо-функциональные экспериментальные исследования позволяют рекомендовать в клинику биоматериал серии Аллоплант «Стимулятор нейро- и васкулогенеза с ингибитором рубца» для миопластики парализованных мимических мышц. При этом, выкраивание лоскутов может быть осуществлено как из височной, так и из собственно-жевательной мышц — со строгим учетом вне- и внутримышечного распределения сосудов и нервов.
На наш взгляд, необходимо обязательно сочетать миопластику мимических мышц со стойким статическим подвешиванием мягких тканей опущенного угла рта, поскольку в ранний послеоперационный период после миопластики главным условием успеха является создание стойкого статического покоя в месте соприкосновения мышечного лоскута жевательной мышцы и парализованной мимической. К тому же, косметический эффект от самостоятельно проведенной миопластической реиннервации выражен будет лишь при напряжении жевательных мышц лица, например, при разговоре или приеме пищи. В покое же косметический дефект будет четко выражен. Ликвидирован он может быть только при сочетании миопластики с эффективным статическим подвешиванием. С этой целью нами разработан биоматериал на основе коллаген-протеогликанового комплекса. Используемая методика его приготовления позволяет получать данный биоматериал различных размеров: толщиной 0,2— 1,2 мм, шириной 2—8 мм, длиной 25—35 см.
Экспериментальные исследования показали, что этот «Биоматериал для статического подвешивания и фиксации органов и тканей» обладает очень высокими прочностными свойствами (Разрывная нагрузка = 27—29 кгс/мм2) при низком коэффициенте удлинения (Е = 0,14—0,16). После подшивания одного конца этого биоматериала в области угла рта к дерме, туннелирования в подкожной клетчатке и проведения второго конца сухожилия к скуловой дуге, производится регулируемое подтягивание угла рта и фиксация к скуловой дуге оригинальным способом.
Заключение и практические рекомендации
«Классическая» миопластика жевательной мускулатурой парализованных мимических мышц не обеспечивает полноценного морфофункционального восстановления последних—в результате формирования грубого соединительнотканного межмышечного рубца, ограничивающего прорастание сосудов и нервных аксонов в парализованные мышцы.
Миопластика денервированных мимических мышц биоматериалом серии Аллоплант — «Стимулятором нейро- и васкулогенеза с ингибитором рубца» создает условия для полного восстановления морфологических и функциональных параметров мимических мышц после их экспериментальной денервации—за счет интенсивного прорастания сосудов и нервных аксонов через рыхлый соединительно-тканный регенерат.
Новый пересадочный биоматериал серии Аллоплант - «Биоматериал для статического подвешивания и фиксации органов и тканей» обладает высокими прочностными свойствами, низким коэффициентом растяжения и обеспечивает надежное статическое подвешивание мягких тканей лица.
Разработанная методика операции «Миопластическая реиннервация мимических мышц со стойким статическим подвешиванием мягких тканей лица биоматериалами серии расширяет диапазон хирургических вмешательств, применяемых при параличах лицевого нерва.
Метод миопластической реиннервации мимических мышц со стойким статическим подвешиванием мягких тканей лица биоматериалами серии Аллоплант - рекомендуется: для лечения парализованных мимических мышц длительностью заболевания свыше 12 месяцев, т. е. в сроки, когда не произошло самостоятельного восстановления функции лицевого нерва и мимических мышц.
В случае проведенного оперативного вмешательства на самом лицевом нерве (шов нерва, невролиз, перекрестное сшивание дистального конца лицевого нерва с центральным концом другого двигательного нерва) и отсутствия эффекта от операции в течении 6 месяцев.
В ранние сроки после наступления паралича мимических мышц для предупреждения наступления дегенеративных изменений в мышцах. В этом случае возможно комбинирование метода миопластики с оперативным вмешательством на лицевом нерве; при этом статическое подвешивание мягких тканей лица можно отсрочить. При восстановлении функции основного ствола лицевого нерва и начала реиннервации мимических мышц, подтверждаемого электрофизиологическими исследованиями, проводится репластика мышцы-донора (собственно-жевательной или височной мышцы), когда ее мышечная ножка отсекается от мимической мышцы, укладывается на свое старое ложе и фиксируется. При отсутствии эффекта от операции на стволе лицевого нерва в течение шести месяцев, выполненная ранее миопластика дополняется операцией подвешивания мягких тканей лица.
В случае выполненной операции на лицевом нерве, когда восстановление функции мимических мышц сопровождается формированием вторичной контрактуры этих мышц.
При длительных сроках заболевания—от 2-х лет и более, когда произошли глубокие дегенеративные изменения мимических мышц. В этом случае миопластика биоматериалами серии Аллоплант обеспечивает прорастание новообразованных мышечных волокон из мышцы-донора в мышечные ложа дегенерированных мимических мышц, значительно замещая их функцию.
После проведенной миопластики активные сокращения мимических мышц некоторое время будут происходить при сокращении жевательных мышц. Поэтому, для получения изолированных сокращений мимических мышц, необходима достаточно длительная тренировка больного перед зеркалом. При этом на наш взгляд, будет происходить формирование новой рефлекторной дуги двигательных нейронов, осуществляющих изолированное сокращение мимических мышц.
Применяемые в нашей работе биоматериалы серии Аллоплант могут быть с успехом использованы и при многих других операциях, например, там, где требуется реиннервация внутренних органов (методом органопексии), надежная фиксация и быстрое заживление операционной (в т. ч. кожной) раны, стойкое подвешивание и фиксация внутренних органов и тканей и др.
Литература
1. Применение биоматериалов серии Аллоплант в реконструктивных операциях на лице при поражении лицевого нерва/ Информационный листок МЗ РСФСР.—М., 1991.—5 с. (Под редакцией проф., д. м. н. Бикмухаметовой X. С. и доц., к. м. н. Нигматуллина Р. Т.
2. Новый биоматериал для надежной шовной фиксации и стойкого статического подвешивания органов и тканей//Вопросы теоретической и практической медицины: Тез. докл. конференции.—Уфа, 1992, 16 с.
3. Моделирование паралича мимических мышц у кролика/лабораторные животные в медико-биологических и биотехнологических исследованиях: Тез. докл. I Международного симпозиума. М., 1992.
4. Новый материал для стойкого статического подвешивания угла рта при параличе мимической мускулатуры лица//Актуальные вопросы биомедицинской и клинической антропологии: Тез. докл. Всесоюзн. научн. конф.—Красноярск.—1992, 105 с.
5. Использование лимфопротекторного действия биоматериалов серии Аллоплант при мионевротизации парализованных мимических мышц кролика//Проблемы саногенного и патогенного эффектов экологических воздействий на внутреннюю среду организма: Тез. докл. Международного симпозиума.—Чолпон-Ата,—1993, 237 с. (Соавторы: Мулдашев Э. Р., Хасанов Р.А., Павлов В.Н.).
6. Лимфопротекторный эффект биоматериалов серии Аллоплант при миопластике парализованных мимических мышц в эксперименте//Вопросы клинической лимфологии: Тез. докл. III межрегиональной научно-практич. конф.—Андижан.—1993,—С. 73—74 (Соавторы: Бикмухаметова X. С, Мулдашев Э. Р., Павлов В. Н., Хасанов Р. А.)
7. Биоматериал для статического подвешивания и фиксации органов и тканей. Положительное решение по заявке на изобретение № 5046852 /02107/бл/14 от 17.05.94 г.
8. Режущий инструмент для проведения нейрохирургических операций. Удостовер. № 1119 от 3.05.88. Башгосмединститут, Уфа, соавторы: Валеева К.Г., Александров Д.П., Сафин Ш.М.
9. Патрубок для электроотсоса. Удостовер. № 1120 от 3.05.88. Башгосмединститут. Уфа, соавторы: Валеева К. Г., Александров Д. П.
10. Устройство для фиксации лабораторных животных. Удостовер. № 1516 от 10.01.94. Башгосмединститут, Уфа.
11. Электрод для электро-физиологических исследований мышц в эксперименте. Удостовер. № 1517 от 18.01.94.
к содержанию | опубликовать статью
АЛЛОПЛАНТ В ХИРУРГИИ ПИЩЕВОДА
Ионис Е. Ю.
ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию,
ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию», г. Уфа
В данной работе разработана методика пластики дефекта стенки пищевода аллогенным трансплантатом. Определены показания к применению аллогенного трансплантата в хирургии пищевода. Разработаны и внедрены в практику методы эзофагопластики при операциях на пищеводе по поводу нейромышечных заболеваний, коротких стенозов, дивертикулов, доброкачественных опухолей пищевода и пищеводно-органных свищей. При перфорациях пищевода разработана и внедрена в практику методика укрепления линии швов аллотрансплантатом.
Актуальность
Для современной хирургии характерно повышение интереса хирургов и исследователей к проблеме лечения повреждений и доброкачественных заболевании пищевода, что связано с увеличением количества больных с заболеваниями пищевода, нуждающихся в оперативном лечении, расширением диагностических возможностей, повышением хирургической техники, появлением новых материалов.
Одно из ведущих мест в заболеваниях пищевода занимают ожоговые стриктуры (Оганесян М.Л., 1989). Достаточно часто встречается ахалазия пищевода - примерно в 20-30% случаев всех заболеваний пищевода. Не редкостью являются дивертикулы пищевода и лейомиомы. Повреждения пищевода происходят в 0,007% случаев эндоскопических манипуляций и в 3-6% случаев при бужировании.
Все перечисленные заболевания и повреждения пищевода нуждаются в хирургическом лечении, зачастую с применением различных пластических материалов.
Из множества методик эзофагопластики при коротких стриктурах пищевода наиболее часто используются традиционные эзофагопластики -желудком, тонкой и толстой кишкой. Недостатком их является: высокая травматичность, сложность и длительность исполнения. К тому же велик риск развития интраоперационных и послеоперационных осложнений: некроз желудка, кишки, рубцовый стеноз зоны анастомоза. По литературным данным летальность после эзофагопластики при рубцовых стриктурах составляет 5,7% (Нарезкин Д.В.,1988).
При хирургических методах лечения ахалазии пищевода с применением эзофагопластики по Геллеру-Ниссену, Суворовой, рецидивы возникают в 3-30% случаев (Черноусое А.Ф. ,1985), а в отдаленные сроки достигают 75% (Topart D., 1992). Это связано с рубцовым сморщиванием краев мышц и соединительно-тканным замещением трансплантата.
Большое количество неудовлетворительных результатов различных эзофагопластик послужило причиной поиска новых методик хирургической пластики пищевода с применением материала, стойкого к воздействию инфекции, надежно укрепляющего линию швов на пищеводе и мало подверженного рубцовой деформации.
Целью данной работы является улучшение результатов хирургического лечения травм и доброкачественных заболеваний пищевода с использованием аллотрансплантата для замещения объемных дефектов тканей серии Аллоплант.
Методы и материалы исследования
Исследования, связанные с замещением дефектов стенки пищевода и укреплением линии швов на пищеводе, проводились на базе ЦНИЛ Башкирского государственного медицинского университета. Для выполнения поставленных целей и задач проведены лабораторные, экспериментальные и клинические исследования.
Математическая обработка данных производилась по общепринятым формулам с использованием IBM-совместимых PC-компьютеров и компьютеров «MACINTOCH». Статистическая обработка проводилась с использованием t-критерия Стьюдента. При статистической обработке использовалась компьютерная программа Microsoft Excel.
Нами в качестве пластического материала был применен аллотрансплантат для замещения объемных дефектов серии Аллоплант.
Во Всероссийском центре пластической хирургии глаза (г.Уфа) из соединительнотканных образований согласно ТУ 42-2-537-87, разработаны трансплантаты, защищенные товарным знаком Аллоплант. Приказом МЗ СССР № 87 901-87 от 22.07.1987г., препараты этой серии разрешены к применению в клинической практике, в частности, аллотрансплантат для замещения объемных дефектов тканей. Аллотрансплантат для замещения объемных дефектов тканей, именуемый в дальнейшем Аллоплант, изготовлен из подкожной клетчатки подошвы, которая имеет выраженную соединительнотканную строму, что обеспечивает его хорошие каркасные свойства и моделируемость. С помощью специальной обработки Аллопланта достигнуто его обезжиривание. Ячейки стромы, оставшиеся на месте нахождения жировых клеток, не спадаются, что способствует сохранению конфигурации органа - мешени или тканей. Отличием этого трансплантата является низкая антигенная активность, обусловленная специальной обработкой, предусматривающей дозированную элиминацию гликозаминогликанов из состава коллагеновых волокон. Процессы приживления проходят без использования иммунодепрессантов.
Форма выпуска: флаконы емкостью 50 мл., размеры 5x3x1 см., флаконы емкостью 400 мл., размеры 9x6x1 см. Стерилизация произведена гамма лучами. Проводится проверка на ВИЧ-инфекцию.
Аллотрансплантат для замещения объемных дефектов серии Аллоплант в клинической практике использовался для контурной пластики лица (Мулдашев Э.Р.,1983), в проктологии (Булгаков А.В., 1991), при пластики туберкулезной каверны (Инченко К.С., 1992), для пластики костных дефектов при остеомиелите, в хирургии печени с целью замещения дефектов (Нартайлаков М.А., 1995), с целью укрепления культи бронха (Авзалетдинов A.M., 1998) и т.д. Данные, представленные авторами, применявшими аллотрансплантат, подтверждают отсутствие иммунной активности на трансплантат, его хорошие пластические свойства.
Мы изучили возможность применения аллотрансплантата для замещения объемных дефектов тканей серии Аллоплант в целях замещения дефекта стенки пищевода и укрепления линии швов на нем.
Для изучения физико-механических свойств применяемого Аллопланта и подбора оптимальной толщины заплаты из него был проведен ряд экспериментов.
На секционном материале выделялся мышечный слой пищевода, прошивался атравматичной нитью №3 на колющей игле, отступя 4 мм от края. Производилась тяга за шов. Прорезывание швов на мышечном слое пищевода происходило при силе натяжения в 0,79±0,18 Н. Проводилась проба на прорезывание швов на Аллопланте. Накладывался один узловой шов атравматичной нитью №3 (мерсилк) на колющей игле отступя 4 мм от края. Толщина пластинок из Аллопланта была 5 мм и 8 мм. Прорезывание шва на Аллопланте толщиной 5 мм произошло при силе натяжения в 9,1 ±0,83 Н. При прилагаемой силе натяжения в 20,4±0,76 Н произошел разрыв нити в месте узла на пластинке из Аллопланта толщиной 8 мм. Прорезывание шва на Аллопланте не произошло. Таким образом, при вшивании в мышечный дефект пищевода, «заплата» из Аллопланта толщиной 5 мм создает 11-кратный запас прочности (Р<0,001).
Изучение физико-механических свойств мышечного слоя пищевода и Аллопланта проведено на разрывной машине Heekert FP-10. Скорость нагружения составляла 20 мм/мин.
На секционном материале проводилась пневмопроба на неизмененном пищеводе. При создании избыточного давления в просвете пищевода до 122,5±14,4 мм. рт. ст. происходил разрыв пищевода. Пневмопроба также проводилась на пищеводе собак через 1,5-2 года после имплантирования Аллопланта в мышечный дефект стенки пищевода. Создавалось избыточное давление до 280 мм. рт. ст. Повреждения пищевода выявлено не было.
Во второй серии опытов материалом исследования служили эксперименты на беспородных собаках. Опыты производились с целью изучения морфологических изменений в стенке пищевода при пластике с использованием аллотрансплантата для замещения объемных дефектов пищевода. Произведено 18 экспериментов на 17 собаках.
Возраст животных колебался в пределах 3-6 лет. Выбирались собаки черного или темно-коричневого окраса. Вес животных варьировал в пределах 7-12 килограмм. Животные содержались в одинаковых условиях в виварии Башкирского медицинского университета. Перед операцией выдерживался срок 7-10 дней с целью адаптации животного к условиям содержания.
Операцию производили под интубационным наркозом. С целью примедикации вводили раствор сернокислого атропина 0,1%- 0,3 подкожно, растворы димедрола 1%-1,0, реланиума 2,0 внутримышечно. Вводный наркоз проводили внутримышечным введением раствора калипсола из расчета 20 мг на кг веса животного.
Через 10-15 минут, когда животные засыпали, производилась интубация трахеи в положении животного на спине и вентиляция кислородно-воздушной смесью с использованием аппарата «Наркон-2». В случаях необходимости продления оперативного вмешательства наркоз дополняли введением 100 мг калипсола интралингвально. Собака фиксировалась на столе в боковом положении, правом или левом в зависимости от выбранного уровня пищевода. Обработка операционного поля начиналась с выстригания волос. Кожа обрабатывалась двукратно 0,5% спиртовым раствором хлоргексидина биглюканата. Операционное поле обкладывалось стерильным материалом.
Проводилась боковая торакотомия справа или слева. Выделяли пищевод. Мышечный слой пищевода рассекали до слизистой на протяжении 2 см. В образовавшийся дефект мышечного слоя вшивали заплату из Аллопланта размерами 2x1 см, толщиной 5 мм. Аллоплант фиксировали к пищеводу «П»- образными и узловыми швами не рассасывающейся нитью (викрил № 2).
Животных выводили из опыта введением больших доз тиопентала натрия с добавлением 5 миллилитров 5% раствора дитилина внутримышечно (Шалимов С. А. и соавт, 1989г.). Для выяснения последовательности развития и характера тканевой реакции на Аллоплант, определения степени уменьшения Аллопланта в размерах животные выводились из эксперимента и подвергались аутопсии через 7, 30 суток, 3 месяца, 6 месяцев, 12 месяцев, 18 месяцев, 24 месяца.
Для морфологического исследования вырезался блок участка пищевода с имплантированным Аллоплантом, проводилось визуальное изучение препаратов сразу после забора материалов, проводились измерения размеров заплаты из Аллопланта.
Выявлено, что размеры Аллопланта через 2 года после операции уменьшались незначительно. Точные размеры определить не удалось, ввиду большой эластичности рубца, образовавшегося на месте Аллопланта. Далее кусочки срезов фиксировали в 10% нейтральном формалине, обезвоживали в спиртах восходящей концентрации и заливали парафином. В каждом опыте готовили 3-5 гистологических срезов. Гистологические срезы окрашивали гематоксилин-эозином. Всего проведено гистологическое исследование 56 срезов.
Клинические исследования
Клинический раздел исследования основан на анализе истории болезней 1 15 больных, оперированных в отделении торакальной хирургии городской клинической больницы №6 города Уфы Башкирского государственного медицинского университета (зав. кафедрой - Академик РАЕН, заслуженный деятель науки Р.Б. и Р.Ф., профессор Плечев В.В, ректор- Академик РАЕН, заслуженный деятель науки Р.Б. и Р.Ф. ,профессор Тимербулатов В.М.) за период с 1983 по 2000 год.
Оперативному лечению подвергнуто 45 (39,1%) больных с нейромышечными заболеваниями пищевода, 29 (25,2%) - со стенозами пищевода, 17 (14,7%) - с дивертикулами, 16 (13,8%) больных оперировано по поводу перфораций пищевода, 3 (2,5%) больных оперировано по поводу свищей пищевода и 5 (4,4%) больных по поводу доброкачественных опухолей пищевода. Основными жалобами при нейромышечных заболеваниях пищевода являлись дисфагия, потеря веса. Показанием для оперативного лечения больных с нейромышечными заболеваниями служили ахалазия и кардиоспазм 2 степени и более (диаметр пищевода более 3 см), потеря веса, наличие дисфагии.
Больные с рубцовыми стенозами предъявляли жалобы на потерю веса, слабость, полную или частичную дисфагию. Показаниями для оперативного лечения по поводу рубцового стеноза пищевода являлись отсутствие длительного эффекта от бужирования и невозможность бужирования в виду высокого риска перфорации во время манипуляции. При дивертикулах пищевода больные предъявляли жалобы на постоянную или периодически возникающую днсфагию, боли. Больные с этой патологией были оперированы при наличии дисфагии или эндоскопически диагностированного дивертикулита. При перфорациях пищевода больные жаловались на боли, а при наличии медиастинита на высокую температуру. При пищеводно-респираторных свищах ведущими жалобами были постоянный кашель и поперхивание во время приема пищи. Больные с доброкачественными опухолями пищевода, как правило, жалоб не предъявляли. Абсолютным показанием для оперативного лечения служило диагностирование перфорации, доброкачественной опухоли и свища пищевода. Больным с перфорацией пищевода операции проводились по экстренным показаниям. В плановом порядке проводились операции больным с рубцовыми стенозами, дивертикулами, нейромышечными заболеваниями пищевода и пищеводно-органными свищами после коррекции водно-электролитного баланса, ликвидации гипопротеннемии, анемии, проведения противовоспалительной терапии.
Основными методами исследования больных с вышеперечисленными заболеваниями являются рентгенологический и эндоскопический методы. Всем больным проводилась обзорная рентгенография органов грудной клетки, полипозиционная контрастная рентгенография или рентгеноскопия пищевода и желудка. При исследовании в качестве контрастного вещества применяли мелкодисперсную бариевую взвесь. При подозрении на нарушение целостности стенки пищевода применяли водорастворимый контраст (тразограф, омнипак). Преимущества водорастворимого контраста заключаются в большей возможности выявления свищей и безопасности при забросе в трахеобронхиальное дерево. При выраженных рубцовых стенозах пищевода и наличии гастростомы проводили ретроградные фиброэзофагоскопии и контрастные рентгенографии пищевода с целью уточнения протяженности стриктуры и выбора вида оперативного вмешательства.
Эндоскопическое обследование проводилось всем 115 больным с помощью аппарата "GIF-30" с прямой оптикой фирмы "Olympus" (Япония) с выводом изображения на монитор и видеозаписью. Фиброэзофагогастроскопия позволяла тщательно исследовать состояние слизистой оболочки пищевода, а при рубцовых стенозах пищевода точно определить уровень стеноза, его диаметр, законченность процесса рубцевания, наличие признаков эзофагита. При дивертикулах пищевода эзофагоскопия позволяла определить точную локализацию дивертикула, что в дальнейшем способствовало выбору оптимального оперативного доступа. Мы применяли интраоперационную фиброэзофагоскопию при хирургическом лечении дивертикулов и перфораций пищевода с целью точного определения места перфорации и устья дивертикула.
В соответствии с целью и задачами исследования все больные были разделены на 2 группы: 1-я группа -62 (53,9%) пациента, которым операции были проведены по общепринятым методикам и 2-я группа-53 (46,1%) пациента, которым проводились операции на пищеводе с применением Аллопланта.
Для более достоверного анализа группы были разбиты на 2 подгруппы - la и 2а-подгруппы, в которых при операциях просвет пищевода не вскрывался, и 1б и 2б подгруппы, в которых при операции был вскрыт просвет пищевода.
В контрольной группе проводились следующие операции при нейромышечных заболеваниях проводилась кардиопластика по Суворовой (19 операций); при стенозах пищевода проводилась, внутриплевральная пластика желудком, загрудинная пластика толстой и тонкой кишкой (всего 19 операций); при перфорациях пищевода производилось ушивание перфорации без укрепления линии швов или с укреплением линии швов мсдиастинальной плеврой (10 операций); при дивертикулах дивсртикулэктомия или инвагинация дивертикула (9 операций); при доброкачественных опухолях пищевода производили вылущивание опухоли с ушиванием дефекта мышечной оболочки (3 операции); при операциях по поводу пищеводных свищей производили ушивание свищевого хода.
Основную группу составили 53 больных, у которых в ходе операции был использован Аллоплант в целях замещения дефекта стенки пищевода или укрепления линии швов на нем. Среди оперированных больных с нейромышечными заболеваниями было 26 больных, со стенозами пищевода-10, с дивертикулами-8, с перфорациями-6, с доброкачественными опухолями-2 больных и один больной с трахеопищеводным свищем. У всех больных, оперированных по поводу рубцового стеноза пищевода был диагностирован короткий рубцовый стеноз (протяженностью не более 5 см) в различных отделах пищевода.
В ходе операции производилось рассечение мышечной и слизистой оболочки пищевода в продольном направлении, иссечение рубцово-измененной слизистой оболочки пищевода с последующим ушиванием ее в поперечном направлении на желудочном зонде диаметром 1 см. При ушивании слизистой оболочки образовывалась крестообразная линия швов. В образовавшийся дефект стенки пищевода вшивали «заплату» из Аллопланта эллипсовидной формы, толщиной 5-8мм.
При операциях по поводу нейромышечных заболеваний пищевода проводилась экстрамукозная эзофагокардиомиотомия на протяжении 7-10 см. Мышечный слой пищевода отсепаровывался от слизистой оболочки на 5-6 мм. В образовавшийся мышечный дефект на желудочном зонде вшивалась «заплата» из Аллопланта эллипсовидной формы. В случае, если Аллоплант был меньше мышечного дефекта, углы мышечного дефекта подшивались к Аллопланту «П» - образными швами. Такой шов плотно фиксирует Аллоплант в мышечном дефекте.
При форсированном натяжении нити в процессе завязывания узла происходит сведение прилегающих к Аллопланту стенок мышечного дефекта. При этом не происходит выдавливания Аллопланта из мышечного дефекта. Таким способом достигается плотный контакт подлежащей ткани с Аллоплантом при надежном сшивании углов мышечного дефекта.
С целью профилактики рефлюкс-эзофагита дно желудка фиксировали к пищеводу 3-4 узловыми швами. Для уменьшения натяжения швов, фиксирующих Аллоплант, эти швы накладывали правее Аллопланта.
В ходе операций по поводу доброкачественных заболеваний пищевода после энуклеации в образовавшийся мышечный дефект вшивали «заплату» из Аллоплант с фиксацией ее «П»-образными швами.
Оперативные вмешательства по поводу дивертикула пищевода выполнялись в 2 вариантах. В случае если дивертикул был не больших размеров, после выделения ножки дивертикул инвагинировали в просвет пищевода узловыми швами. Затем мышечный слой также ушивался узловыми швами. Если дивертикул был размерами более 2 сантиметров, выделяли ножку дивертикула, производили днвертикулэктомию, ножку ушивали узловыми швами атравматичной нитью. В случае если дефект мышечный дефект стенки пищевода был велик, и его ушивание привело бы к стенозированию, в дефект вшивалась «заплата» из Аллопланта по вышеуказанной методике. В случае если ушивание мышечного дефекта было допустимо, после наложения швов на мышечный слой пищевода по верх линии швов укладывалась заранее подготовленная пластинка из Аллопланта таких размеров, чтобы покрывать линию швов с запасом в пределах одного сантиметра. Толщину пластинки мы оставляли около 5 миллиметров. При такой толщине пластинка из Аллопланта не теряет прочностных качеств и в тоже время лучше моделируется. Аллоплант фиксировали к пищеводу узловыми швами синтетической нитью (викрил) с атравматичной иглой с шагом 6-7 миллиметров.
При перфорациях пищевода проводилось ушивание перфоративного отверстия, затем линия швов укреплялась по методике, применяемой при операциях по поводу дивертикула пищевода.
Сравнение результатов лечения основной и контрольной групп
При сравнении по качественным признакам больных в основной и контрольной группе значительных расхождений в распределении по возрасту и нозологическим формам заболевания не выявлено, поэтому полученные результаты можно считать сравнимыми.
В контрольной группе возраст больных был в пределах от 20 до 88 лет. В возрасте 20-29 лет было 11 больных, в возрасте 30-39 лет- 14 больных, 40-49 лет- 19 больных, 50-59 лет- 15 больных, 60-69 лет- 1 больных, 70-79 лет- 1 больной, свыше 80 лет- 1 больной. Средний возраст составляет 42,9 лет. 59 (95,2%) больных были работоспособного возраста.
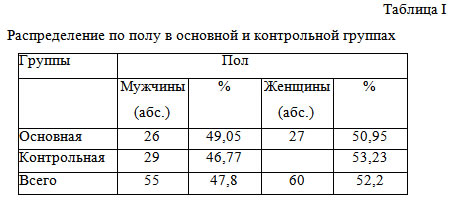
В основной группе возраст больных был в пределах от 16 до 74 лет. До 19 лет было 2 больных, в возрасте 20-29 лет- 7 больных, 30-39 лет- 8 больных, 40-49 лет- 19 больных, 50-59 лет- 13 больных, 60-69 лет- 1 больной, 70-79 лет- 3 больных. Средний возраст составляет 44,6 года. 45 больных (92,5%) были работоспособного возраста.
Для правильной оценки выбора хирургического лечения большое значение имеет анализ послеоперационных осложнений и отдаленных результатов. Нами проведено сравнение результатов хирургического лечения в контрольной и основной группе. При анализе послеоперационных осложнений в контрольной группе были получены следующие данные. В раннем послеоперационном периоде было выявлено 24 осложнения у 23 больных. В одном случае наряду с развитием несостоятельности швов пищевода развилось нагноение послеоперационной раны. При операциях со вскрытием просвета пищевода осложнения возникли в 16 случаях. Такое серьезное осложнение, как несостоятельность швов на пищеводе возникло у 12 больных (в 6 случаях при операциях по поводу рубцового стеноза пищевода, в 4 случаях после операции по поводу перфорации и в 2 случаях - после дивертикулэктомии).
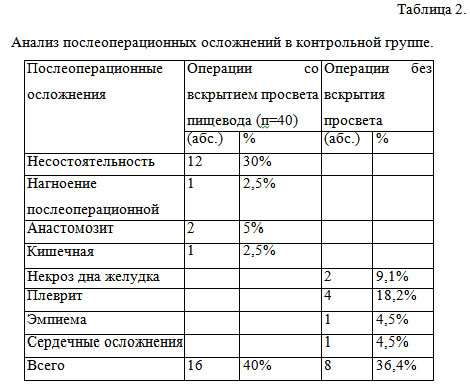
При операциях без вскрытия просвета пищевода, в послеоперационном периоде осложнения возникли в 8 случаях. Наиболее грозными осложнениями были 2 случая некроза дна желудка при кардиопластике по Суворовой.
В основной группе послеоперационные осложнения развились у 8 больных. После операций, проведенных без вскрытия просвета пищевода у 2 больных развился плеврит, который удалось купировать однократными пункциями.
При операциях, проводимых со вскрытием просвета пищевода, осложнения развились у 6 больных (в 4 случаях - несостоятельность швов на пищеводе и в 2 случаях плеврит). Несостоятельность швов развилась в двух случаях после операции по поводу перфорации пищевода, в одном случае после пластики пищевода по поводу рубцового стеноза и в одном случае после операции по поводу дивертикулеза пищевода (2 больших дивертикула).
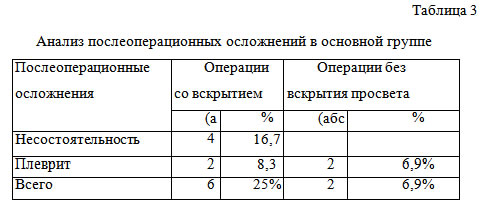
Анализ результатов хирургического лечения показывает снижение возникновения несостоятельности швов в 2,5 раза в основной группе по сравнению с контрольной группой (19,4% и 7,5% соответственно).
Нами был проведен анализ летальности. В контрольной группе после оперативного лечения умерло 8 больных: 3 больных со стенозом пищевода, 2-с дивертикулом пищевода, 2-с перфорацией и 1 больной с ахалазией пищевода. После операций, проведенных без вскрытия просвета пищевода, умерло 2 больных: одна больная от инфаркта миокарда в раннем послеоперационном периоде после инвагинации дивертикула, у второго больного после кардиопластики по Суворовой произошло ущемление дна желудка, развилась эмпиема плевры. Смерть наступила от интоксикации.
В основной группе у одного больного несостоятельность швов пищевода после операции по поводу перфорации привела к смерти.
В контрольной группе у больных оперированных со вскрытием просвета пищевода послеоперационная летальность составила 15%, среди больных, оперированных без вскрытия просвета пищевода, летальность составила 9,1%.
В основной группе среди больных, оперированных со вскрытием просвета пищевода, летальность составила 4,2%. Среди больных, оперированных без вскрытия просвета пищевода, летальных исходов не было.
Отдаленные результаты получены у 23(36,5%) из 62 больных в контрольной группе и у 21(36,9%) из 53 больных в основной группе.
Отдаленные результаты оценивались по трехбалльной системе - хороший, удовлетворительный, неудовлетворительный.
Хороший результат - полное восстановление проходимости пищевода, свободное питание через рот, восстановление массы тела.
Удовлетворительный результат - небольшое или непостоянное затруднение глотания, незначительная дисфагия при приеме грубой пищи, свободной прохождение жидкой и полужидкой пищи.
Неудовлетворительный результат - отсутствие эффекта от лечения, смертельный исход.
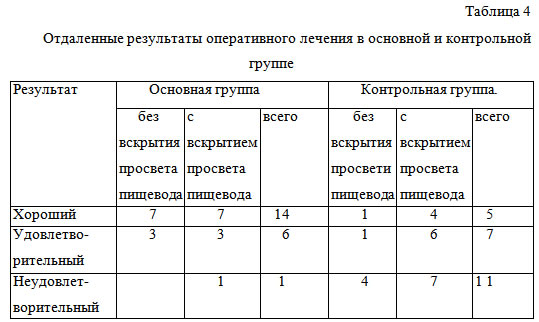
В контрольной группе хорошие результаты получены в 21,8%, удовлетворительные — в30,4%, неудовлетворительные — 47,8% случаев.
В основной группе хорошие результаты получены в 66,6%, удовлетворительные - в 28,6%, неудовлетворительные - в 4,8% .
По поводу рецидива нейромышечных заболеваний .оперировано пять больных. Двое из этих больных ранее оперированы в нашем отделении.
У всех больных первая операция проводилась по общепринятым методикам. У трех больных повторная операция выполнена по методике Т.А. Суворовой, у двух больных выполнена аллопластика.
У одной больной после пластики по Суворовой рецидив наступил через 7 лет. Проводились неоднократные курсы бужирования пищевода -без эффекта. После операции с применением аллопластики больная выписана в удовлетворительном состоянии.
Заключение и практическая значимость
Устранение дефекта стенки пищевода с использованием Аллопланта позволяет достичь герметичности шва, усиления его прочностных свойств. Применение Аллопланта исключает условия для возникновения «фитильной инфекции».
Морфологические исследования, проведенные в различные сроки после имплантации Аллопланта в стенку пищевода показали, что Аллоплант подвергается постепенной резорбции с одновременным замещением его соединительной тканью без изменения первоначальных размеров.
Операции с применением Аллопланта в целях замещения дефекта стенки пищевода и укрепления швов на пищеводе у больных с травмами и доброкачественными заболеваниями пищевода являются органосохраняющими, менее травматичными по сравнению с традиционными операциями, позволяют избежать стенозирования пищевода в месте оперативного вмешательства.
После операций с применением Аллопланта несостоятельность швов напищеводе развивалась в 2,5 раза реже, чем после выполнения общепринятых операций. Применение Аллопланта способствовало увеличению доли хороших и удовлетворительных отдаленных результатов хирургического лечения в 1,9 раза.
Результаты проведенных клинических исследований позволяют рекомендовать в широкую клиническую практику методы пластики пищевода с использованием Аллопланта при нейромышечных заболеваниях пищевода, стенозах, дивертикулах, перфорациях, доброкачественных заболеваниях пищевода и при пищеводно-органных свищах.
Аллоплант в хирургии пищевода может быть использован как для замещения дефекта мышечного слоя пищевода, так и для укрепления линии швов с целью профилактики их несостоятельности.
Применяя Аллоплант при дивертикулах необходимо учитывать величину образовавшегося мышечного дефекта. В случае если ушивание дефекта влечет за собой стенозирование пищевода, то Аллоплант рекомендуется вшивать в дефект, если же стенозирование не происходит, то Аллоплантом укрепляется линия швов. Все манипуляции на пищеводе необходимо проводить на желудочном зонде.
Применение Аллопланта обосновано при коротких стенозах пищевода. Длина Аллопланта должна соответствовать длине стеноза.
Прочностные свойства Аллопланта позволяют выкраивать заплату из него толщиной, соответствующей толщине мышечного слоя пищевода.
При операциях по поводу перфораций целесообразно ушивать перфоративное отверстие пищевода с применением Аллопланта, не смотря на время, прошедшее с момента перфорации.
Литература
-
1.Аллопластические операции в хирургии пищевода. Новые технологии в хирургии. Международный симпозиум / Н.Г Гатауллин, E.IO. Ионис, Я.У.Булгаков, А.Ф.Батулин. // Уфа 1994. С. 100-101.
-
Alloplant in esophagus surgery/ Y.U. Bulgakov, E.R. Muldashev, R.T. Nigmatulin, E.Y. lonis //Rev Inst Nal Enf Resp Мех.1994; 7(2) P. 113-1 15.
-
Операции на пищеводе с применением Аллопланта. Юбилейный сборник научных трудов городской больницы №6/ Н.Г. Гатауллин, Е.Ю. Ионис, Р.Г. Фатихов, Ф.Ш. Исмагилов //Уфа 1995. С. 48-50.
-
Хирургическое лечение новообразований средостения. Актуальные вопросы онкологии / В.В.Плечев, Е.Ю. Ионис, Р.Г. Фатихов, Я.У. Булгаков, A.M. Авзалетдинов//Уфа 1995. С. 30-31.
-
Аллопластика в хирургии пищевода. Всероссийский симпозиум «Новые технологии в хирургии»/ В.В.Плечев, Н.Г. Гатауллин, ЕЛО. Ионис, Я.У. Булгаков, Ф.Ш. Исмагилов, A.M. Авзалетдинов //Уфа 1996 С. 173-174.
-
Пластические операции в хирургии пищевода. Республиканская научно-практическая конференция «Актуальные проблемы хирургии и морфологии»/Н.Г. Гатауллин, Е.Ю. Ионис, В.В.Плечев, Р.Г. Фатихов // Уфа 1998 С. 81-84.
-
Торакоабдоминальные ранения. Тактика и варианты лечения. Эндоскопия в хирургии легких. Республиканская научно-практическая конференция «Актуальные проблемы хирургии и морфологии»/ Н.Г. Гатауллин, В.В.Плечев, Е.Ю. Ионис, Я.У. Булгаков, Ф.Ш. Исмагилов // Уфа 1998. С. 74-76.
-
Эндоскопические методы диагностики и лечения рубцовых cтриктур пищевода. Республиканская научно-практическая конференция «Актуальные проблемы хирургии и морфологии» / В.В. Плечсв, A.M.
-
Иткин, Е.Ю. Ионис, Л.Р. Козленке, С.Е. Дунюшкин, Р.Ф. Ганиев. //Уфа 1998. С. 79-80.
Рационализаторские предложения
-
Способ Пластики при коротких стенозах пищевода, (рац. предл. 2257 от 15.09.2000. БГМУ соавт. В.В. Плечев, Я.У. Булгаков).
-
Способ Фиксации аллотрансплантата в мышечном дефекте стенки пищевода, (рац.предл. 2258 от 15.9.2000. БГМУ соавт Н.Г. Гатауллин, В.В. Плечев, Я.У. Булгаков).
к содержанию | опубликовать статью
КЛИНИКО-ЭКСПЕРИМЕНТАЛЬНОЕ ОБСЛЕДОВАНИЕ ПРИМЕНЕНИЯ БИОТРАНСПЛАНТАТА АЛЛОПЛАНТ В ХИРУРГИЧЕСКОЙ РЕАБИЛИТАЦИИ БОЛЬНЫХ С ПОСЛЕОПЕРАЦИОННЫМИ ОБЪЕМНЫМИ ДЕФЕКТАМИ МОЛОЧНОЙ ЖЕЛЕЗЫ
Благодетелев И. Л.
ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
В работе автора определены показания для выполнения одномоментной маммопластики биоматериалом Аллоплант, разработан способ его применения при хирургическом лечении доброкачественных узловых образований молочной железы. На основании экспериментальных исследований и клинических наблюдений выявлена способность Аллопланта для создания оптимальных условий регенерации и заживления пострезекционных ран у больных с доброкачественными узловыми заболеваниями молочной железы. С помощью математических расчетов определены оптимальные размер и форма электродов для реомаммографии.
Актуальность
Проблема хирургической реабилитации больных с приобретёнными послеоперационными дефектами молочной железы занимает одно из центральных мест современной пластической хирургии.
Неудовлетворительные косметические результаты (потеря объёма, деформация, асимметрия груди, грубые рубцы) при резекции молочной железы по данным разных авторов наблюдаются в 18,6-59,7% случаев (А.Т. Адамян, Р.А. Шагиахмстова,1986; А.В. Хохлов, 1990; Р.А. Нигматуллин, 1998).
Опыт реконструктивно-восстановительной хирургии молочной железы свидетельствует о глубокой связи эффективности проводимой операции с индивидуальными эмоциональными и социально-психологическими установками данной категории больных (ВЛ. Васютков с соавт., 1997; J.3d.Bostwick, 1990).
Вопросы реконструкции объема и формы молочной железы нашли отражение в материалах Всесоюзной конференции "Актуальные вопросы пластической хирургии молочной железы" (Москва, 1990), Всесоюзном симпозиуме "Кожная пластика в гнойной хирургии" (Москва, 1990), Межрегиональном симпозиуме "Органосохраняющая и реконструктивно-пластическая хирургия в онкологии" (Челябинск, 1997), 3-й Всероссийской научно-практической конференции "Новые технологии в хирургии" (Уфа, 1998), 2-й и 3-й Международной конференции "Современные подходы к разработке эффективных перевязочных средств, шовных материалов и полимерных имплантатов" (Москва, 1995, 1998).
Существующие способы коррекции врождённых и приобретённых дефектов молочной железы (инъекционные методы введения полужидких синтетических или биологических материалов, эндопротезирование, пересадка кровоснабжаемых аутокомплексов) не всегда позволяют добиться хороших косметических и функциональных результатов, что нередко вынуждает прибегнуть к повторным оперативным вмешательствам (О.Б. Добрякова, 1996; Y.G.Illouz, I990; S.E.Gabriel ct al., 1997).
Весьма перспективным направлением в развитии маммопластики является внедрение в хирургическую практику биоматериалов. Однако основной проблемой трансплантологии остаётся преодоление реакции отторжения. С этой точки зрения, использование аллостатических материалов, лишенных антигенных свойств и не требующих проведения иммуннодепрессивной терапии, признаётся наиболее целесообразным (Э.Р. Мулдашев и др., 1993).
Аллотрансплантат для замещения объёмных дефектов тканей (сокращенно Аллоплант), разработанный во Всероссийском центре глазной и пластической хирургии (г.Уфа) и нашедший широкое применение в различных областях хирургии, сочетает в себе многие положительные стороны пластических материалов: широкая доступность, хорошая моделируемость, простота консервации, в том числе и на длительные сроки, устойчивость сохранения размеров. Он обладает противовоспалительными и гемостатическими свойствами, низкой антигенностыо (Р.Т. Нигматуллин, 1995).
Уникальные свойства данного пластического материала во многом предопределили цель и задачи настоящего исследования.
Цель исследования: разработать методические подходы и оценить клиническую эффективность биоматериала Аллоплант для пластики послеоперационных объемных дефектов молочной железы у женщин.
Материал и методы исследования в эксперименте
Экспериментальные исследования проведены на 20 половозрелых крольчихах породы «Шиншилла», которым выполнена секторальная резекция молочной железы с одномоментной пластикой раневой полости биоматериалом Аллоплант. Анестезию осуществляли внутривенным введением кетамина из расчёта 2-3 мг на кг веса. В ходе эксперимента проводилось динамическое наблюдение за животными.
Забор материала па гистологическое исследование осуществлялся на 7. 14, 21, 28, 60, 90 и 180 сутки после операции. Гистологические срезы готовились толщиной до 5 микрон, окрашивались гематоксилином и эозином, пнк-рофуксином по Ван-Гизонну, азуром и эозином по Лилли, фукселипом по Харту с последующим изучением под биологическим микроскопом при увеличении х75, х150, х400.
Изучение основных показателей иммунного статуса подопытных животных проводилось перед операцией, а также на 7, 14, 28, 90 и 180 сутки эксперимента. В полученных пробах гепаринизированной крови и сыворотки крови определялись следующие показатели: общее количество лейкоцитов, полиморфноядерные лейкоциты (псевдоэозинофилы), лимфоциты, Т - лимфоциты, фагоцитарная активность лейкоцитов, спонтанный и индуцированный латексом НСТ - тест, активность комплемента, титры гетероагтлютининов. Исследования выполнены общепринятыми методами (Р.М. Хаитов и др., 1995).
Материал и методы исследования в клинике
Клинический материал основан на изучении историй болезни и результатов лечения 167 больных с доброкачественными узловыми образованиями молочной железы, которые были разделены на 2 группы в соответствии с использованием традиционного способа лечения (контрольная группа - 103 больных) и разработанного способа с применением Аллопланта (основная группа - 64 больных). Комплексное обследование включало клинические, лабораторные, морфологические и инструментальные методы исследования.
Общеклиническое обследование основывалось на изучении жалоб, анамнеза, общего и локального статуса. Возраст пациенток от 16 до 45 лет, средний - 30,4. Продолжительность заболевания составила от 1 месяца до 1 года у 73,0%, свыше 1 года у 27,0% больных.
По локализации узловых образований распределение было следующим: правая железа - 48,5%, левая - 44,3%, двухстороннее поражение - 7,2% случаев. Вовлечение в патологический процесс одного квадранта молочной железы наблюдалось в 83,7% случаев в контрольной группе и 85,5% случаев в основной группе, двух и более квадрантов - соответственно 16,3% и 14,5%. Чаще поражался верхне-наружный квадрант (38,0%). Размеры узлов составили от 1 до 8 см.
Морфологические методы включали цитологическое исследование перед операцией, экспресс - биопсию во время операции и гистологическое исследование макропрепаратов. Узловая мастопатия выявлена у 45,5%, фиброаденома - у 47,9%, липома - у 3,6%, внутрипротоковая папиллома - у 3,0% больных.
Лабораторные методы предусматривали изучение гематологических (эритроциты, лейкоциты, лейкоцитарная формула, гемоглобин, СОЭ), биохимических (общий белок, глюкоза, билирубин, мочевина) и иммунологических показателей (Т-лимфоциты и их популяции, иммуноглобулины Л, M,G, циркулирующие иммупокомплексы, фагоцитоз нейтрофилов и макрофагов).
Маммография проводилась на отечественном аппарате «Электроника» при неясных диагностических случаях, а также с целью уточнения распространённости патологического процесса.
Ультразвуковое исследование молочных желёз входило в комплекс дооперационного обследования, а также выполнено у 15 больных после маммопластики с целью изучения динамики структурных изменений в молочных железах. Эхография проведена на аппаратах Siemens SI-450 и SSD-650 с частотой датчика 7,5 Мгц.
Реография молочных желёз проведена на отечественном реографе 4 РГ-2М у 25 больных в сроки до 6 месяцев после операции и предусматривала оценку реограмм и определение реографического (РИ) и диастолического (ДИ) индексов. Для усиления записи полезного сигнала применена автоматизированная диагностическая система «Кредо», разработанная сервисным центром ТОО «ДНК и К» (г.Тверь, 1993).Метод реографии молочных желез до настоящего времени не нашёл широкого применения. Одной из причин получения некачественных результатов является эмпирический подбор электродов для данного исследования (Р.Х. Тукшаитов, 1991). Для повышения чувствительности метода и достоверности результатов нами с помощью математических расчетов определены наиболее оптимальные размер и форма электродов (удостоверение на рац. предложение № 2127 от 16.11.99г., выд. БГМУ).
Результаты исследования и их обсуждение
Экспериментальные морфологические исследования выполнены на базе научно - исследовательской лаборатории Всероссийского центра глазной и пластической хирургии. Как известно, репаративная регенерация при трансплантации биоматериалов связана с факторами реципиента, реализующимися через тканевое ложе и факторами самого трансплантата (Р.Т.Нигматуллин, 1996). При этом автором предложено выделение контактной, краевой и реактивной зон тканевого ложа, непосредственно прилегающих к трансплантату.
На 7 сутки эксперимента выявлено плотное окружение трансплантата тяжами незрелой соединительной ткани, которая содержит множество мелких сосудов. В многообразном клеточном составе краевой и реактивных зон тканевого ложа превалировали лимфо - гистиоцитарные элементы. По периферии трансплантата отмечалось набухание коллагеновых волокон и миграция фибробластов из тканевого ложа.
На 14 сутки отмечена деградация стромы трансплантата. Грануляционная ткань мелкими фрагментами огибала жировые дольки. Стенки вновь образованных сосудов становились двухрядными. В краевой зоне тканевого ложа на фоне уменьшения общего количества клеточных элементов наблюдался рост числа фибробластов веретенообразной формы. В реактивной зоне начиналось формирование капиллярного русла.
На 21 сутки продолжалась дальнейшая деструкция трансплантата с разрушением жировых долек. Границы трансплантата становились расплывчатыми. Прорастающая соединительная ткань приобретала черты оформленной. Воспалительная инфильтрация была незначительная.
На 28 сутки эксперимента доминировали процессы замещения трансплантата, реактивные изменения в тканевом ложе нивелировались. В оформленной соединительной ткани преобладали фиброциты. Сосуды равномерно распределялись в структуре стромы и вокруг молочных ходов.
Через 2 месяца границы трансплантата различить невозможно. Остатки деградированного трансплантата определялись в виде чешуек. Начиналось формирование собственной жировой ткани. По периферии трансплантата прослеживались элементы паренхимы молочной железы.
На 90 сутки остатки трансплантата выявлялись в виде бесформенных масс. Регенерирующие элементы паренхимы молочной железы были представлены узкими протоками фестончатого типа и формирующимися альвеолами и занимали значительную часть исследуемого материала.
На 180 сутки наблюдалось полное замещение трансплантата паренхимой и стромой, идентичной но структуре окружающей её ткани молочной железы. Молочные ходы были функционального вида.
Таким образом, динамику репаративпых процессов при пластике раневых дефектов молочной железы можно представить следующим образом: незначительные сосудистые изменения в тканевом ложе > умеренный лимфо -гистиоцитарный инфильтрат > выраженная макрофагальная стадия > медленное формирование структурно адекватного регенерата и образование ткани молочной железы, состоящей из зрелой оформленной соединительной ткани с разнонаправленной ориентацией пучков и собственно железистой ткани.
Послеоперационных осложнений, отторжения трансплантата у экспериментальных животных не наблюдалось.
Анализ показателей иммунного статуса подопытных животных не выявил достоверных изменений во все сроки исследования. Можно предположить, что прослеженная ареактивиость иммунной системы в сочетании с отсутствием клинических признаков воспалительных явлений в зоне трансплантации указывает на хорошую приживляемость Аллопланта.
Опираясь на свойства биоматериала Аллоплант и результаты экспериментальных исследований нами разработан способ маммопластики с его применением при лечении доброкачественных узловых образований молочной железы (удостоверение на рац. предложение № 2044 от 31.03.99 г., выданное БГМУ).
Разработанный способ заключается в следующем. Под внутривенной анестезией выполнялась секторальная резекция молочной железы с патологическим образованием в центре в пределах здоровых тканей, отступя 2-3 см от узла. При этом кожа не иссекалась. Проводился тщательный гемостаз. Ткань молочной железы не ушивалась. Остаточная раневая полость заполнялась Аллоплантом в количестве, соответствующим объёму полости. Трансплантат вплотную прилегал к стенкам дефекта. Па поверхностный листок фасции и подкожную клетчатку накладывались узловые швы. В рапу устанавливалась резиновая полоска с целью дренирования на 24-48 часов. Кожа ушивалась внутрикожным швом, который снимался па 7-8 сутки после операции.
Биоматериал Аллоплант извлекался из флакона стерильным инструментом в условиях операционной и перед трансплантацией помещался в стерильный физиологический раствор с добавлением антибиотиков широкого спектра не менее 5 минут.
Объём остаточной раневой полости измерялся погружением резецированной ткани в мерную посуду с антисептиком или путём заполнения полости антисептическим раствором из градуированной посуды. В 40 случаях (58,9%) объём составил от 60 до 100 см3 , в 29 случаях (4 1,1%)-101 - 130 см3.
Показанием к разработанному способу маммопластики служило наличие объёмного послеоперационного дефекта после выполнения резекции молочной железы и занимающего 1/2 квадранта и более. Противопоказанием к данному способу считали злокачественные новообразования молочной железы, пролиферативную форму мастопатии.
Выбор оперативного доступа определялся локализацией и размерами узлового образования. Радиальный доступ использован в 154 (86%), периареолярный - 18 (10%), субмаммарный - 7 (4%) случаях.
По разработанной нами методике проведено 69 хирургических вмешательств у 64 больных, в том числе: секторальная резекция с аллопластикой в 57 случаях, широкая секторальная резекция с аллопластикой в 12 случаях. Хирургическое лечение по традиционному способу заключалось в проведении секторальной или широкой секторальной резекции молочной железы.
Непосредственные и отдаленные результаты лечения больных изучены в сроки до 6 лет. Клиническая оценка проводилась на основании опроса и осмотра больных, а также анализа лабораторных, эхо- и реографических исследований.
Послеоперационные раневые осложнения при традиционном способе наблюдались у 13 больных, что составило 12,6%, в том числе: гематома и серома по 4,8%, нагноение раны у 3,0%. При маммопластике с применением Аллопланта осложнения отмечены у 2 больных (гематома и серома по 1 случаю), что составило 3,1%. Таким образом, раневые осложнения при разработанном способе отмечались в 4 раза реже. Общий срок лечения больных контрольной группы составил 16,0 ± 0,5 дней, основной - 13,0 ± 0,5 дней. Имеется достоверное сокращение общего срока лечения на 3,0 суток (р< 0,001).
Для оценки отдалённых результатов лечения нами разработана рабочая классификация косметических и функциональных нарушений оперированной молочной железы.
1. Косметические нарушения молочной железы:
1.1 .По характеру рубцов:
1.1.1. Атрофические (широкие, втянутые).
1.1.2. Гипертрофические.
1.1.3. Келоидные.
1.2.По степени нарушения формы молочной железы:
1.2.1. Отдельные или множественные рубцы, не влияющие на форму органа.
1.2.2. Рубцы, сопровождающиеся изменением формы органа.
1.3.По степени потери объёма молочной железы:
1.3.1. Частичная потеря (квадранта, половины или 2/3 органа).
1.3.2. Полная потеря.
1.4. По локализации нарушений:
1.4.1. Односторонняя.
1.4.2. Двухсторонняя.
1.5. По степени нарушения сосково - ареолярного комплекса:
1.5.1. Рубцовая деформация.
1.5.2. Девиация (смещение) соска.
1.5.3. Втяжение соска.
2. Функциональные нарушения молочной железы:
2.1. Нарушения секреторно - выделительной (лактационной) функции:
2.1.1. Снижение лактации (гиполактия).
2.1.2. Отсутствие лактации (агалактия).
2.1.3. Лактостаз.
2.2.Нарушение эстетической функции (удовлетворённости внешним видом молочной железы). При сопоставлении результатов в обеих группах зарегистрированы существенные различия. Косметические нарушения были представлены патологическими рубцами у 49,5% больных в контрольной группе и у 23,4% в основной, рубцовой деформацией молочной железы соответственно у 23,3% и 1,5%, деформацией ареолы в 14,5% и 1,5% случаев.
Частичная потеря органа выявлена у 45 больных (43,6%), в том числе: потеря 1/4 объёма у 35,9%, потеря 1/2 объёма у 6,8%, потеря 2/3 объёма у 1 больной (0,9%). В основной группе потеря 1/4 объёма железы констатирована у 1 больной, что составило 1,5%.
Косметический результат оценивался нами по 3-х бальной системе: хороший, удовлетворительный и неудовлетворительный. К хорошим косметическим результатам отнесены случаи отсутствия каких - либо косметических дефектов, к удовлетворительным - наличие невыраженного атрофического или гипертрофического рубца, не приведшего к деформации железы, к неудовлетворительным - наличие одного или нескольких дефектов (грубые рубцы, потеря часта органа, рубцовая деформация, деформация ареолы).
Исходя из анализа работ отечественных и зарубежных авторов, а также собственных наблюдений, можно заключить, что при хирургическом лечении доброкачественных узловых образований молочной железы послеоперационные косметические нарушения носят актуальный характер.
Хорошие и удовлетворительные косметические результаты в контрольной группе составили соответственно 13,6% и 26,2% (всего 39,8%), в основной группе соответственно 70,3% и 21,9% (всего 92,2%) случаев. Неудовлетворительные косметические результаты в контрольной и основной труппах составили соответственно 60,2% и 7,8%.
Лактационная функция изучена у 8 женщин, имевших роды в послеоперационном периоде. У 2 из 4 женщин контрольной труппы и у 1 из 4 женщин основной группы отмечено снижение лактации (гиполактия).
С целью оценки эстетических нарушений у оперированных больных нами проведён опрос их на предмет удовлетворённости внешним видом. Удовлетворительный результат отметили в контрольной группе 38,8% опрошенных и 85,9% в основной труппе. Неудовлетворительный результат получен соответственно у 61,2% и 14,1%.
При анализе гематологических и биохимических показателей крови в сроки до 28 суток после операции существенных изменений, как в контрольной, так и в основной группах не выявлено. Изучение показателей иммунного статуса у больных контрольной группы выявило незначительный рост лимфоцитов, однако достоверных изменений показателей клеточного и гуморального звена во все сроки наблюдения не отмечено.
В основной группе зарегистрировано достоверное повышение уровня Т-лимфоцитов (Е-РОК) и Т-активных лимфоцитов па 28 и 90 сутки (р<0,05 по сравнению с исходным уровнем). При этом оба показателя оставались в пределах нормы. Можно предположить, что применение Аллопланта при пластике послеоперационных дефектов у больных с доброкачественными узловыми образованиями молочной железы оказывает иммуннокоррегирующее влияние.
При УЗ исследовании молочных желез в ранние сроки после маммопластики (до 2 месяцев) определялась зона пониженной эхогенности с чёткими контурами, которая соответствовала расположению аллогенного трансплантата. В дальнейшем отмечалось постепенное уменьшение этой зоны, границы ее становились размытыми. В сроки 6 месяцев после операции эхо-структура ткани молочной железы была идентична во всех нолях. Образования капсулы вокруг трансплантата не отмечено.
На основании динамики РИ и ДИ отмечено значительное улучшение регионального кровообращения в оперированной молочной железе у больных основной группы, начиная с 3 месяцев наблюдения. При этом изменения РИ носили достоверный характер (р<0,001 по сравнению с нормальными показателями). Результаты реографических исследований свидетельствовали о позитивном влиянии Аллопланта па регенеративные процессы при пластике молочной железы.
Таким образом, анализ экспериментальных и клинических результатов показал целесообразность и обоснованность использования биологического материала Аллоплант для пластики послеоперационных объёмных дефектов молочной железы.
Заключение и практические рекомендации
При резекции молочной железы по поводу доброкачественных узловых образований частичная потеря объема органа наблюдается у 43,6%, рубцовая деформация железы у 23,3%, нарушения сосково-ареолярного комплекса (втяжение, девиация) у 14,5% больных.
Пластика пострезекционных дефектов молочной железы биоматериалом Аллоплант у экспериментальных животных выявила полное замещение трансплантата окружающими его гомологичными тканями и отсутствие патологических реакций в них. Гистологические изменения, возникшие в процессе индуцированной регенерации при трансплантации, носили стойкий характер.
Маммопластика с использованием Аллопланта является эффективным и доступным способом коррекции послеоперационных объемных дефектов молочной железы.
Использование Аллопланта при хирургическом лечении больных с доброкачественными узловыми образованиями молочной железы позволило сократить общий срок лечения на 3,0 суток, снизить неудовлетворительные косметические нарушения с 60,2% до 7,8%, эстетические результаты с 61,2% до 14,1%.
Показанием к применению биоматериала Аллоплант при хирургическом лечении доброкачественных узловых образований молочной железы является наличие объемного раневого дефекта, образовавшегося после резекции и занимающего ½ квадранта и более.
Выбор оптимального доступа определяется локализацией и размерами патологического образования. Опухоли, расположенные вблизи ареолы и в центральном квадранте молочной железы, иссекаются через периаореолярный разрез. При локализации узла в верхних квадрантах используется овально-радиальный доступ, в нижних квадрантах – разрез под молочной железой.
Резекция железы осуществляется в пределах здоровых тканей, отступя 2-3 см от края опухоли. Во Время операции проводится тщательный гемостаз промывание остаточной раневой полости антисептическим раствором, которая заполняется Аллоплантом соответственно её объёму и форме. До пересадки аллотрансплантат в течение не менее 5 минут выдерживается в физиологическом растворе с антибиотиком широкого спектра действия. Операция завершается наложением узловых швов на поверхностный листок фасции и подкожную клетчатку, установлением на 1-2 дня резинового выпусника между швами. Кожа ушивается внутридермальным швом, который снимается через 7-8 суток.
Противопоказанием к выполнению данного способа маммопластики являются злокачественные новообразования, пролиферативная форма мастопатии.
После оперативного вмешательства необходимо проведение консервативной патогенетической терапии в течение 1,5-2 лет, направленной на предупреждение рецидива заболевания. Диспансерное наблюдение за этой категорией больных не должно ограничиваться какими-либо сроками.
Литература
1. Р.А.Нигматуллин, В.Г.Сахаутдинов, И.Л. Благодетелев. Пластика молочной железы аллотрансплантатом при хирургическом лечении её доброкачественных заболеваний: Методические рекомендации МЗ РБ.-Уфа, 1997.- Юс.
2. В.Г.Сахаутдинов, Р.А.Нигматуллин, И. Л. Благодетелев, К. А. Нигматуллин. Резекция и первичная пластика молочной железы аллотрансплантатом по поводу доброкачественных узловых образований //3-я Всероссийская научно - практическая конференция "Новые технологии в хирургии" и Пленум Проблемной комиссии РАМН "Колопроктология" и правления Ассоциации колопроктологов России: Сборник тезисов, 28-29 мая 1998 года.- Уфа, 1998.-С.274-275.
3. И.Л. Благодетелев, Г.Р. Валеева. Морфологические аспекты маммопластики с использованием биотрансплантатов в эксперименте //Актуальные вопросы общей и военной патологической анатомии: Материалы научной конференции, посвященной 140-летию кафедры патологической анатомии Военно-медицинской академии (23-24 апреля 1999 года).- С-Петербург, 1999.-С.47-48.
4. И.Л. Благодетелев, Ю.А. Медведев, В.П. Кривоногов, В.В. Сперанский, Д.В. Пахомов, Р.А. Нигматуллин. Клинико-иммунологическая оценка аллотрапсплантации при пластике молочной железы в эксперименте //Вопросы иммунопатологии и иммунореабилитации: Материалы конференции - Уфа: Изд. «Здравоохранение Башкортостана», 1999.- С.53-55.
5. Р.А.Нигматуллин, И.Л.Благодетелев, А.С.Фатхуллин. Аллотрансплантаты для маммопластики //Актуальные вопросы здравоохранения Республики Башкортостан: Материалы межрегиональной научно - практической конференции, посвященной 25-летию Белорецкой городской больницы (15-10 октября 1999 года).- Белорецк, 1999.-С.99-100.
Рационализаторские предложения
1. Способ хирургического лечения доброкачественных узловых образований молочной железы //Удостоверение БГМУ №1856 от 10.02. 1998г. (соавт. Р.А. Нигматуллин, К.А. Нигматуллин).
2. Способ маммопластики //Удостоверение БГМУ № 2044 от 22.03. 1999г. (соавт. Р.А. Нигматуллин, А.С. Фатхуллин).
3. Электроды для реомаммографии //Удостоверение БГМУ № 2127 от 09.1 I. 1999г. (соавт. Р.А. Нигматуллин. А.С. Фатхуллин).
к содержанию | опубликовать статью
ВНУТРИПЕЧЕНОЧНАЯ СТИМУЛЯЦИЯ РЕГЕНЕРАЦИИ В КОМПЛЕКСЕ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ БОЛЬНЫХ С ХРОНИЧЕСКИМИ ДИФФУЗНЫМИ ЗАБОЛЕВАНИЯМИ ПЕЧЕНИ
экспериментально-клиническое исследование
Мингазов Р. С.
Впервые разработан способ создания множественных внутрипеченочных депо биоматериала Аллоплант, обладающего длительным эффектом и достоверно ведущего к стимуляции регенерации паренхимы печени с последующим улучшением ее морфофункционального состояния. Экспериментально и клинически впервые продемонстрировано снижение электрокинетических показателей эритроцитов, адекватно отражающих активность и степень воспалительного процесса в паренхиме печени при ее хронических диффузных поражениях. Установлено, что положительные изменения в электрофоретической подвижности эритроцитов (ЭФПЭ) являются чутким индикатором эффективности проводимого лечения.
Актуальность темы
В настоящее время во всем мире наблюдается рост хронических заболеваний печени, являющихся следствием перенесенного вирусного гепатита, так и воздействия на нее различных техногенных ксенобиотиков. Последнее особенно характерно для Республики Башкортостан с большой концентрацией химических и нефтеперерабатывающих производств (С.Д. Подымова, 1993).
Острота проблемы обуславливается также тем, что применяющиеся ныне методы диагностики и лечения не позволяют адекватно оценить степень активности воспалительного процесса в паренхиме печени и тяжести её поражения, а используемые консервативные способы лечения гепатитов и циррозов печени носят в основном симптоматический характер (А.Ф. Блюгер с соавт., 1966; А.Ф. Блюгер, Э.З. Крупникова, 1979; А.С. Логинов, 1981; Х.Х. Мансуров, 1987).
Эти методы лечения зачастую не останавливают нарастания патологического процесса в печени и перехода хронического гепатита в цирроз с его печально известным финалом. Так, смертность от цирроза печени, по данным ВОЗ, в Европе за последние 20 лет возросла и достигла 10 на 100000 в Болгарии, Финляндии, Нидерландах, Норвегии и Англии.
В то же время недостаточно четко сформулированы показания к хирургическому лечению хронического активного гепатита и цирроза печени до развития его основного осложнения в виде портальной гипертензии с её разнообразными и грозными проявлениями.
В последние годы сформировались два основных направления хирургического лечения вышеуказанных заболеваний:
1.Операции, направленные на прерывание воспалительного процесса в печени, а именно – на улучшение внутрипеченочного кровообращения, уменьшения холестаза, стимуляцию регенеративных процессов в органе (О.С. Шкроб с соавт., 1981; Д.В. Усов, 1985; Т.В. Нарциссов, 1986; И.АП. Сафин, 1986; И.Н. Беседа, 1990; Ш.С. Чургосиев, 1990; С.А. Пышкин с соавт., 1990).
2.Операции, направленные на коррекцию развившихся осложнений диффузного поражения печени, в основном – цирроза, как-то: различные виды портоковального шунтирования, перитонеовенозного шунтирования, разобщение пищеводно-желудочных анастомозов и др. (М.Д.Пациора, 1974; Д.Ю.Кривченя с соавт.,1987; Ф.Г.Назыров с соавт.,1987; А.А.Шалимов с соавт., 1988).
Известно, что одним из основных звеньев патогенеза хронического активного гепатита и, в особенности цирроза печени, является перестройка микрососудистого русла органа на фоне извращенной иннервации, избыточного развития соединительной ткани при одновременном нарушении реологических свойств печеночно-воротной крови и постоянно нарастающей гипоксии гепатоцитов (С.А.Гальперин с соавт., 1973; Г.Е.Островерхов, 1973; И.А.Сафин, 1986; В.В.Серов, 1989). Исходя из этого значительный интерес представляют операции первой группы, а именно, направленные на стимуляцию регенерации печени (А.В.Береснев, 1969; Б.П.Солопаев, Н.А. Бобышев, 1980; Л.И.Аруин, 1987). Так, после резекции печени восстановление ее паренхимы обеспечивается массивным размножением клеток во всем органе (И.М.Солопаева,1969; Б.И.Альперович,1975). Известны и такие способы хирургической стимуляции регенерации печени, как лазерная резекция, посегментарная частичная резекция печени, очаговая электрокоагуляция диафрагмальной поверхности органа и др. (С.А. Пышкин,1983; Д.В.Усов, 1985; Т.В.Нарциссов,1985). Считается, что при перечисленных методиках пусковым механизмом стимуляции регенерации печеночной паренхимы являются вещества, образующиеся в момент гибели печеночных клеток на месте нанесения какого-либо воздействия на ткань печени, Однако применение большинства из вышеуказанных способов хирургической стимуляции регенерации для патологически измененного органа является достаточно травматичным, а их стимулирующий эффект - кратковременным.
В то же время остаются нерешенными многие вопросы, такие как: выбор момента для проведения хирургического лечения хронических диффузных заболеваний печени, способы создания благоприятных условий для стимуляции регенерации печеночной паренхимы, процессы биодеградацни соединительной ткани, недостаточно определены критерии оценки активности и степени выраженности воспалительного процесса в печени.
В связи с вышеуказанным представляется актуальным поиск новых методов симуляции регенерации печени, создание оптимальных условий для этого, разработка показаний к оперативному лечению и критериев эффективности проводимого лечения при хроническом активном гепатите и циррозе печени.
Целью данной работы явилась разработка нового способа стимуляции регенерации печени при хроническом активном гепатите, ее цирротическом поражении и критериев эффективности проводимого хирургического лечения.
Материалы и методы исследования
Для стимуляции регенерации печени использовали аллотрансплантат, изготовленный по технологии, разработанной в Российском центре глазной и пластической хирургии для трансплантатов серии Аллоплант. Трансплантаты изготавливаются из различных соединительнотканных образований трупа человека согласно ТУ 42-2-537-87, разрешены к применению Минздравом СССР (регистрационное удостоверение N 87/901-87 от 22 июля 1987 года).
Аллотрансплантат для внутрипеченочной стимуляции представляет собой продукт химической обработки аллогенных тканей с последующей дезинтеграцией, лиофилизацией и гамма-стерилизацией. Он содержит такие компоненты внеклеточного матрикса, как коллаген, протеогликаны, гликопротеины, гликозаминогликаны и выпускается во флаконах емкостью 5 мл в виде мелкодисперсного порошка, В офтальмохирургии подобный трансплантат используют при дистрофических заболеваниях сетчатки и зрительного нерва. Доказано, что он не вызывает сильной воспалительной реакции и стимулирует пролиферацию сосудов и клеток соединительной ткани.
Материалы и методы экспериментального исследования. В первой серии с целью определения влияния Аллопланта на репаративные процессы в печени провели эксперимент на 30 кроликах обоего пола породы 'Шиншилла" весом 2,5-3,0 кг. Цирротические изменения печени получены путем подкожного введения 50% масляного раствора четыреххлористого углерода из расчета 0,1-0,2 мл на 1 кг веса животного 2 раза в неделю в течение 2,5-3,0 месяцев. Цирроз печени у экспериментальных кроликов подтвержден визуальным осмотром печени при вскрытии брюшной полости и гистологически.
За 12 часов до операции кроликам отменяли пищу, питье. Операцию проводили под барбитуровым наркозом: внутриплеврально вводили 5% раствор тиопентала натрия из расчета 25-50 мг/кг веса животного. В последующем проводили обработку операционного поля: выстригание волос по линии будущего разреза, обработку кожи 0,5% спиртовым раствором хлоргексидина биглюконата, обкладывание стерильными салфетками. Анальгезию дополняли постойной инфильтрацией передней брюшной стенки и париетальной брюшины 0,25% раствором новокаина.
После лапаротомии в рану выводили доли печени, в каждую из которых вводили по 0,1-0,2 мл суспензии аллотрансплантата для стимуляции регенерации.
Кроликов выводили из опыта на 7, 14, 30 сутки, через 90 и до 270 дней введением летальных доз гексенала. При этом производили макроскопическую оценку состояния печени и забор кусочков ее тканей для гистологического' изучения по общепринятой методике. Для обзорного изучения состояния паренхимы печени срезы окрашивались гематоксилин-эозином. Соединительную ткань исследовали с помощью трехцветной окраски по Маллори. Для выявления гликогена ставилась ШИК-реакция. Всего исследовано 58 образцов печени от 25 кроликов, взятых до и после стимуляции регенерации в указанные выше сроки. Гистологическому исследованию подверглись 1200 препаратов.
Для изучения ультраструктуры гепатопитов до и после стимуляции регенерации взято 8 биоптатов из печени экспериментальных животных. Материал фиксировался в 3% глютаровом альдегиде с последующей дофиксанией в 1% растворе осьмиевой кислоты на фосфатном буфере. Ультратонкие срезы готовились на ультратоме LКВ толщиной 0,3 - 0,5 мкм, контрастировались уранил-ацетатом и уксуснокислым свинцом. Препараты просматривались под электронным микроскопом JЕМ-7А (JEOLЯпония) при инструментальном увеличении от 7,5 до 30000 раз.
При оценке результатов стимуляции регенерации учитывались степень выраженности цирротических изменений печени: фиброз соединительнотканного каркаса паренхимы, наличие ложных долек, жировая дистрофия гепатоцитов, очаги некроза. Регенераторная активность оценивалась по состоянию паренхимы; восстановлению ее балочной структуры, гипертрофии или гиперплазии гепатоцитов, их ультраструктуре, наличию очагов двуядерных клеток.
Во второй серии для оценки электрокинетических свойств эритроцитов серии произвели моделирование токсического гепатита и цирроза печени на 50 белых беспородных крысах весом 180-200 г. Четыреххлористый углерод вводили внутрижелудочно по 0,1-0,2мл 50° % раствора в растительном масле 3 раза в неделю в течение трех месяцев. Для оценки электрокинетических свойств эритроцитов кровь бралась из хвостовой вены крыс в количестве 0, 1 мл в забуференный физиологический раствор рН=7,4 и анализировалась при температуре 25°С на измерительном комплексе "Пармоквант-2" фирмы Карл-Цейс-Йена при разведении 1:200. Наряду с оценкой средней величины ЭФПЭ на основании анализа формы кривой распределения эритроцитов по их заряду дополнительно рассчитывали коэффициенты асимметрии Аs, дисперсии Sd и экcцесса Ех распределения с помощью пакета программ Statistika for Windows.
Кроме того, определяли содержание триглицеридов в крови животных на автоматическом анализаторе "Encor".
Результаты экспериментальных исследований
При гистологическом исследовании печени кроликов в результате моделирования цирроза выявлены типичные для этой патологии изменения.
В первые дни после введения диспергированный биоматериал Аллоплант гистологически определялся в виде массы гомогенных частиц различной величины и формы, окрашенных по Маллори в синий и красный цвета, а по Ван Гизону - в интенсивно желтый цвет. Через 15 дней вокруг биоматериала и между его частицами наблюдались врастающие тяжи новообразованной соединительной ткани и кровеносных капилляров, а также интенсивная инфильтрация лейкоцитами и мононуклеарами. Воспалительная реакция со стороны прилежащей паренхимы быта слабой, отмечался незначительный отек и инфильтрация лейкоцитами, а также признаки сосудистого стаза вокруг трансплантата и в портальном тракте.
Через 15 суток после стимуляции биоматериалом, в паренхиме: печени определялись участки с рядами пролиферирующих гепатоцитов; они отличались малыми размерами и имели хорошо окрашенные ядро и цитоплазму. Двуядерные клетки наблюдались преимущественно вокруг портального тракта.
Через 30 суток после введения биоматериала у кроликов макроскопически отмечено увеличение размеров печени и веса. Заметно нормализовалась консистенция и цвет органа, края становились заостренными, исчезал асцит. Поверхность печени несколько сглаживалась и выглядела неравномерно мелкозернистой или даже гладкой.
Гистологически обнаруживались признаки обратного развития |цирроза, которые выражались в истончении фиброзных прослоек между дольками и вокруг портального тракта и нормализации структуры паренхимы, К этому сроку крупные частицы трансплантата почти полностью рассасывались и замещались тяжами новообразованной соединительной ткани и регенерирующими гепатоцитами. В прилежащей к месту введения биоматериала зоне вокруг портального тракта и центральных вен начинали формироваться печеночные балки с рядами регенерирующих гепатоцитов. Электронномикроскопически в ядрах этих гепатоцитов отмечались признаки увеличения синтеза ДНК, в цитоплазме заметно увеличивалось количество органелл, особенно митохондрий и каналов гранулярного эндоплазматического ретикулума. Одновременно отмечался лизис коллагеновых волокон и резорбция их купферовскими клетками.
В последующие сроки наблюдения (2-3 месяца) процессы нормализации структуры ткани печени становились более выраженными. Место введения биоматериала не определялось, так как его частицы полностью замещались рыхлой соединительной тканью, между тяжами которой отмечено формирование "гепатом". Фиброзные прослойки между дольками истончались и исчезали, уменьшалась гистиоцитарная инфильтрация. Общая структура печени еще сохраняла атипичность, но при окраске по Маллори паренхима имела уже типичный для нормы сиренево-голубой цвет.
Через 7 месяцев после введения биоматериала Аллоплант макроскопически печень приобрела вишневый цвет и гладкую поверхность, края были слегка закруглены, Гистологически печеночная ткань в целом сохраняла некоторые признаки атипичности, особенно в месте введения биоматериала. Но вокруг портального тракта и центральных вен уже были сформированы типичные печеночные балки и определялась нормальная структура гепатоцитов.
Представленные в данном разделе результаты исследований позволяют сделать вывод о том, что введение диспергированного биоматериала Аллоплант в паренхиму печени стимулирует регенерацию гепатоцитов, инициирует инволюцию цирротической ткани. Введенный биоматериал подвергается резорбции и в поздние сроки эксперимента не определяется в паренхиме печени.
Изучение ЭФПЭ крыс показало, что удаление 50% печеночной паренхимы вызывает изменения электрокинетических характеристик эритроцитов. Непосредственно после операции ЭФПЭ животных с оперированной печенью падала на 4,97% и восстанавливалась до исходного уровня через неделю. Аналогичные изменения ЭФПЭ отмечались при моделировании токсического гепатита путем внутрижелудочного введения крысам ССL4 на 50 день затравки.
При этом периоду наибольшего снижения биоэлектрических показателей соответствует и наиболее яркая картина поражения печени, признаками которой были облысение животных и ахоличный кал.
Корреляциоиный анализ результатов показал независимость варьирования ЭФПЭ крыс от традционными клинико-биохимических показателей. Достоверная связь регистрировалась лишь между уровнем триглицеридов в крови (г=0.33; р>0.05), что свидетельствует о роли нарушения мембранных структур в механизмах снижения ЭФПЭ.
Введение кроликам с моделированным циррозом диспергированного материала Аллоплант вызывало восстановление паренхимы печени, причем морфологогистологические данные коррелировали с биофизическими, демонстрирующими улучшение биоэлектрических показателей эритроцитов кролика через месяц после действия биостимулятора.
Таким образом, проведенные эксперименты показали, что в цирротически измененной печени кроликов при введении диспергированного материала Аллоплант происходит восстановление структуры паренхимы. Оно идет одновременно двумя путями - пролиферации гепатоцитов и внутриклеточной регенерации. По-видимому, продукты резорбции биоматериала стимулируют метаболическую и пролиферативную активность гепатоцитов и купферовских клеток, что способствует обратному развитию цирротических процессов и регенерации печени. Одним из звеньев эффективной регенерации является восстановление нормальных биоэлектрических свойств эритроцитов.
Материалы и методы клинического исследования. Клинический материал включает в себя анализ результатов обследования и лечения 34 пациентов с хроническим активным гепатитом и 56 больных циррозом печени, находившихся на оперативном лечении в хирургическом отделении N 1 ГКБ N 8 г.Уфы и гастрохирургическом отделении Республиканской клинической больницы им.Г.Г.Куватова в период с 1989 года по июнь 1997 года.
При анализе клинического материала была использована классификация заболеваний печени, принятая ВОЗ в 1974 году (Акопулько, Мексика), Необходимо подчеркнуть, что в данной работе речь идет о больных хроническими диффузными заболеваниями печени, обозначенными в указанной классификации как хронический активный гепатит и различные виды цирроза печени.
По этиологическому фактору пациенты распределились следующим образом: хронические гепатиты и циррозы печени вирусной, алкогольной, токсической этиологии. Часть больных была выделена в отдельную группу с невыясненной этиологией цирроза (табл. 1.).
| Диагноз | Вирусный | Алкогольный | Токсический | Не выявлено | Всего | Из них оперировано |
|---|---|---|---|---|---|---|
| Хрон. активный гепатит | 25 | 3 | 3 | 3 | 34 | 24 |
| Макронодулярный цирроз | 13 | 1 | - | 13 | 35 | 35 |
| Микронодулярный цирроз | 4 | - | - | 1 | 5 | 5 |
| Смешанный цирроз | 4 | 4 | 1 | 5 | 14 | 14 |
| Билиарный цирроз | - | - | - | 1 | 2 | 2 |
| Всего, % | 51,1 | 15,6 | 6,7 | 25,6 | 100 | 88,89 |
Диагностика хронических гепатитов и циррозов печени складывалась путем анализа жалоб, данных анамнеза, правильной опенки клинических проявлений, результатов общеклинических, биохимических исследований по общепринятым методикам. Кроме того, для уточнения состояния кровообращения в печени проводили реогепатографию на аппарате 4РГ-1А с анализом гепатограмм доА.С.Логинову и Ю.Т.Пушкарю (1962), последние два года реогепатографию производили на автоматизированном реографическом комплексе КРЕДО.
Всего,% 51,1 15,6 6,7 25,6 100 88,89 Как видно из табл. 2, среди больных преобладали женщины - 74,4%, преимущественно младше 40 лет - 82,1%. Для оценки портальной гипертензии и гемодинамических нарушений воротного кровообращения проводили трансумбиликальную портоманометрию в динамике в различные сроки после операции аппаратом Вальдмана. С целью оценки поглотительно-выделительной функции печени производилась радиоизотопная гепатография с помощью радио¬активного красителя-бенгальского розового, меченного Йод-131 на аппарате УРУ-1-0-1 (Киев) по стандартной методике. Для определения размеров, формы, положения печени и оценки ее макрофагальной системы применяли радиоизотопное скенирование печени, получаемое на установке "Сцинтикарт-М" типа МВ-8100 фирмы "Гамма" (Венгрия) внутривенным введением радиофармацевтического препарата "Технефит, 99 м ТС", а также коллоидных растворов радиоизотопного индия (In) и золота (Au 198).
| Диагноз | всех больных | Возраст | |||||||
|---|---|---|---|---|---|---|---|---|---|
| <20л | 20-40л | 40-60л | >60л | ||||||
| м | ж | м | ж | м | ж | м | ж | ||
| Острый вирусный гепатит холеста-тической формы, затяжное течение | 34 | 3 | 8 | 8 | 15 | - | - | - | - |
| Хронический активный гепатит | 34 | 3 | 8 | 8 | 15 | - | - | - | - |
| Макронодулярный цирроз | 35 | - | 13 | 5 | 10 | 1 | 4 | 1 | 1 |
| Микронодулярный цирроз | 5 | - | 1 | 3 | - | 1 | 1 | - | 1 |
| Смешанный цирроз | 14 | - | 1 | 3 | - | 1 | 1 | - | 1 |
| Билиарный цирроз | 2 | - | - | - | - | - | 2 | - | - |
| Всего | 90 | 3 | 24 | 17 | 31 | 2 | 10 | 1 | 2 |
| % | 100 | 3,3 | 26,6 | 18,8 | 34,4 | 2,2 | 11,1 | 1,1 | 2,2 |
Оценка морфологического состояния печени производилась как лапароскопически с использованием лапароскопа " Шторц " фирмы "Карл - Цейсс - Йена", так и интраоперационно с гистологическим изучением пункционных и интраоперационных биоптатов печени.
Для выявления активности и степени тяжести воспалительного процесса в печени использовали определение хемилюминесценции сыворотки крови и средних молекул по стандартным методикам, иммуноглобулинов сыворотки крови методом радиальной иммунодиффузии по Манчини, количество комплемента определяли по 50% гемолизу, титр антител определяли с помощью реакции пассивной гемаглютинации по Бойдену.
Оценку электрокинетических свойств эритроцитов проводили на автоматическом комплексе " Пармоквант - 2 ". Для этого у больных из пальца брали 0,1 мл крови, которую помещали в пробирку с 20 мл забуференного физиологического раствора (рН=7,4). В каждой пробе анализировали электроповерхностные свойства 150 эритроцитов.
Кислотно - щелочное состояние (КЩС) и газовый состав капиллярной крови оценивали на измерительном приборе " Аструп " на основании оценки следующих показателей: Нb - концентрация гемоглобина, г %; рН - истинное рН; РСО2 - истинное значение РСО2, мм рт.ст.; PO2 - истинное значение РО2, мм рт.ст.; рО2 st - содержание кислорода в условиях, приведенных к стандартным, мм рт.ст.; НСОз -бикарбонат плазмы или истинное значение бикарбоната в плазме, ммоль/л; ТСО2 - общий СО2 в плазме, ммоль/л; АВЕ - истинный избыток оснований в крови, ммоль/л; 8ВЕ-стандартный избыток основания или избыток основания в крови, ммоль/л; 8ВС-стандартный бикарбонат в крови, ммоль/л; SАТ - насыщение гемоглобина %; дыхательный коэффициент (ДК = СО2:О2).
Показания к оперативному лечению ставились на основании комплексной оценки результатов обследования больных, отсутствия эффекта от консервативной терапии, выявления активности воспалительных изменений в паренхиме печени, при появлении признаков развития портальной гипертензии или явлений ее нарастания.
Результаты комплексного хирургического лечения больных с применением внутрипеченочной стимуляции регенерации печени. Нами было произведено комплексное хирургическое лечение 24 больных с хроническим активным гепатитом и 56 больным с циррозом печени.
С целью улучшения печеночно-воротного кровообращения мы выполнили периартериальную неврэктомию 24 больным с хроническим активным гепатитом и 28 больным на стадии компенсированного и субкомпенсированного цирроза печени в сочетании с другими операциями. Спленэктомия произведена 46 больным, из них с хроническим активным гепатитом - 7, с циррозом печени в различных стадиях - 39, Показаниями к спленэктомии служили высокая активность воспалительного процесса по показателям функциональных проб печени, картина аутоиммуноагрессии по данным иммунологических исследований, явления портальной гипертензии и спленомегалия с проявлениями гиперспленизма.
Не демонстрируя все возможные показатели, характеризующие влияние этих двух операций на протекание хронического активного гепатита и цирроза печени, нам хочется выделить из них лишь отражающие изменения кровотока в печени, портального давления, изменения показателей иммуноагрессии и электрокинетических характеристик эритроцитов (табл.3.).
Как видно из таблицы, применение периартериальной неврэктомии общепеченочной артерии в сочетании со спленэктомией приводит к достоверному снижению портального давления и улучшению печеночно-воротного кровообращения.
| Диагноз | Кол-во больных | К, мм | I | ТА, сек | Ож, сек | сек | Портал давлен., мм рт ст |
|---|---|---|---|---|---|---|---|
| Хронический активный гепатит, до операции |
16 | 4,90± 0,55 | 0,43± 0,03 | 0,13± 0,01 | 0,14± 0,01 | 0,42± 0,01 | 160,5± 14,5 |
| Хронический активный гепатит, после операции |
12 | 8,6± 0,91 | 0,75± 0,11 | 0,7±0,01 | 0,14±0,01 | 0,49± 0,02 | 136,2± 27,3 |
| Р | <0,01 | <0,01 | <0,01 | <0,01 | <0,01 | <0,01 | |
| Цирроз печени в компенсированной и субкомпенсированной стадиях, до операции | 28 | 4,88± 0,17 | 0,41± 0,01 | 0,12± 0,01 | 0,14±0,02 | 0,47± 0,06 | 239,26± 21,65 |
| Цирроз печени в компенсированной и субкомпенсированной стадиях, после операции | 19 | 7,5±1,05 | 0,76±0,02 | 0,15± 0,03 | 0,18±0,02 | 0,68± 0,04 | 158,5± 10,10 |
| Р | <0,001 | <0,001 | >0,05 | >0,05 | >0,05 | <0,01 | |
| Цирроз печени в декомпенсирован-ной стадии, до операции | 8 | 3,88± 0,36 | 0,28+ 0,28 | 0,1± 0,01 | 0,15+ 0,01 | 0,40± 0,03 | 385,25+ 27,3 |
| Цирроз печени в декомпенсирован-ной стадии после операции | 8 | 4,10±0,04 | 0,31± 0,08 | 0,12±0,01 | 0,16±0,01 | 0,42± 0,02 | 337,75± 13,15 |
| Р | >0,05 | >0,05 | >0,05 | >0,05 | >0,05 | >0,05 |
Изучение уровня противопеченочных антител у больных после спленэктомии показало следующие результаты: до операции у всех из них были обнаружены антитела с различным уровнем титра разве¬дения, в том числе у 6 - 1:32, у 17 - до 1:64, у 21 - свыше 1:256 и у 2 -свыше 1:512. В ближайшие сроки после спленэктомии (время пребывания в стационаре) у 21 больного с повышенным титром антител отмечалось его снижение до нормального уровня, у остальных он оставался повышенным и тенденция к его снижению появилась лишь при выписке из стационара (в среднем к концу 3 недели со дня операции). В последующем при обследовании через год у больных, перенесших спленэктомию (25) у 15 титр противопеченочных антител был на уровне 1:16, у 10 - 1:64. Обследование больных с ХАГ и ЦП выявило снижение средней ЭФПЭ у больных гепатитом на 9% и циррозом печени на 11%, сочетающееся у последних с явлениями анемии (табл 4.)
Таблица 4 Клинические показатели и средняя ЭФПЭ больных
| Показатели | Контроль | Гепатит | Цирроз печени |
|---|---|---|---|
| n=18 | n=20 | n=16 | |
| ЭФПЭ 10-8 М2/ вс | 1,12± 0,041 | 1,02± 0,028 | 1,001± 0,02 |
| Эритроциты, 10 13/л | 4,5± 0,04 | 3,50± 0,028 | 2,76± 0,43 |
| Гемоглобин, г/л | 142± 3,9 | 124± 2,1 | 76± 0,43 |
| Лейкоциты, 10 9/л | 6,2± 0,20 | 4,05± 0,19 | 3,9± 0,54 |
После денервации общей печеночной артерии существенно повышался поверхностный заряд эритроцитов, что отражает характер изменений метаболических процессов в гепатоцитах и эритроцитах, в частности, активацию пентозофосфатного цикла в клетках.
Показатели ЭФПЭ сразу после операции: ЭФПЭ ср=0,984 10-8м 2/вс, Sd=0.069, Аs=-0.305 10-8м 2/вс, Ех=-0.437 10-8м 2/вс, через 4 месяца после операции величина средней ЭФПЭ достигла 1,018 10-8 м 2/вс, Sd=0,074, Аs= 1,366 10-8м 2/вс, Ех=-0.267 10-8 м 2/вс. Результаты свидетельствуют о повышении ЭФПЭ, что соответствует более эффективной доставке кислорода клеткам печени.
В комплексе хирургического лечения хронических диффузных заболеваний печени значительное место занимают и портокавальные органные анастомозы. С этой целью нами выполнена оментогепатопексия как дополнение к другим видам оперативных вмешательств при циррозе печени у 37 больных.
Для стимуляции регенерации (при картине перехода хронического активного гепатита в цирроз печени, сформировавшийся цирроз в компенсированной, в субкомпенсированной и, даже, в дистрофической стадиях) производилось введение биостимулятора Аллоплант в дозе до 1,0 мл безигольным инъектором БИ-8 под давлением (сила сжатия энергетической пружины инъектора составляла 30 кгс) во II-VI и, по возможности в VII сегменты печени, по 1-2 инъекции в каждый сегмент.
Предварительно стандартный флакон порошка (10г) биоматериала разводили на стерильном физрастворе в объеме до 15-20 мл. Данная методика введения биостимулятора была выбрана исходя из работ Гигаури К.К. и собственных экспериментов на трупном материале по разработке способов внедрения в печень биостимулятора.
Место впрыскивания биоматериала на 1-2 минуты прижималось: плотным тупфером для профилактики возможного истечения крови и желчи из места инъекции.
Данная методика применена нами у 11 пациентов с хроническим активным гепатитом и 53 больным с циррозом печени. Стимуляция регенерации по этой методике до 1995 г. в ряде случаев сочеталась с очаговой диатермокоагуляцией ее диафрагмальной поверхности, а в дальнейшем применялась лишь стимуляция Аллоплантом.
Изучение корреляционных связей между ЭФПЭ и клинико-биохимическими показателями больных показало, что она варьирует независимо от уровня прямого и непрямого билирубина, мочевины, креатинина, белка в крови. Анализ показателей КЩС в связи с электрокинетическими параметрами эритроцитов показал существенные нарушения регуляции КЩС выражающиеся в повышении содержания бикарбонатионов в крови, свидетельствующие о развитии метаболического алкалоза и изменении трансмембранного потенциала клеток.
Проведенный корреляционный анализ подтвердил, что снижение ЭФПЭ коррелирует с возрастанием сродства гемоглобина к кислороду (г=0,49, p<0,05) и, следовательно, с уменьшением способности эритроцитов отдавать кислород тканям.
Полученные результаты выявили необходимость коррекции, в первую очередь, КЩС крови больных с хроническим активным гепатитом и циррозом печени. С этой целью нами была изучена возможность применения ряда препаратов для коррекции поверхностного заряда эритроцитов и, в конечном счете, расстройства микроциркуляции и уменьшения гипоксии печеночных клеток. Высокая эффективность выявлена у токоферола, который хотя и незначительно повышает среднюю ЭФПЭ, однако инициирует выраженное снижение доли клеток с аномальным зарядом.
Особое внимание в ряду изученных препаратов занимает трентал (пентоксифиллин или его аналоги), увеличивающий тканевой кровоток в печени до 1,5 раза, повышающий содержание АТФ в эритроцитах и соответственно их эластичность.
Таким образом, исходя из наших исследований, вытекает настоятельная потребность регуляции КЩС крови в послеоперационном периоде у больных с хроническими диффузными заболеваниями печени и применение препаратов, повышающих мембранный потенциал эритроцитов, что позволяет уменьшить гипоксию печеночных клеток и создает более благоприятный фон к протеканию регенеративных процессов в печени.
Для этой цели мы применили инфузии вышеуказанных лекарств внутрипортально, у 75 оперированных больных из 80 (в 5 случаях канюлирование не удалось по техническим или анатомическим причинам).
Состояние больных в послеоперационном периоде до выписки из стационара оценивалось в динамике по изменению жалоб, объективных данных, общеклинических анализов, данных иммунограммы и биофизических методов исследования, показателей эритрофореграмм, на основании результатов ультразвукового исследования и радиоизотопного скенирования печени.
В целом, оценивая ранний послеоперационный период, можно отметить, что при операциях с выполнением внутрипеченочной стимуляции регенерации печени Аллоплантом по сравнению с ранее применяемыми способами стимуляции репаративных процессов сокращался срок нахождения пациентов в реанимационном отделении - в среднем на 30% и более. Также, менее чем обычно, были выражены явления печеночно-почечной недостаточности и корригировались они быстрее.
В отдаленном послеоперационном периоде наблюдались 34 больных в сроки до 6 лет. Лишь у двух больных, оперированных по поводу первичного билиарного цирроза, отмечали кратковременный эффект (до 3 месяцев) от оперативного лечения, включающего периартериальную неврэктомию, симуляцию регенерации, оментогепатопексию и канюлирование воротной вены, что соответствует литературным данным и отражает, по-видимому, нарастание аутоимунной агрессии. У 32 из них по всем параметрам отмечалось значительное улучшение состояния. У 20 исчезли асцит, желтуха, нормализовались биохимические показатели крови, сохраняются лишь незначительные сдвиги в показателях иммунограмм и эритрофореграмм. У 17 больных регрессировали явления варикозного расширения вен пищевода, 14 пациентов сняты с инвалидности и работают по специальности. Особый интерес представляют больные, которым внутрипеченочная стимуляция регенерации Аллоплантом производилась по поводу крупноузлового атрофического цирроза печени - у них по данным ультразвукового и радиоизотопного скенирования размеры печени увеличились и приблизились к норме, отмечается нормализация структуры органа. У 11 пациентов в отдаленном периоде отмечается незначительный асцит, периодически повышаются показатели билирубина и трансаминаз, сохраняются сниженными электрокинетические показатели эритроцитов и умеренные изменения в иммунограммах. Однако 6 из них занимаются индивидуальной трудовой деятельностью и лишь 5 пациентов находятся на 3 группе инвалидности.
Таким образом, наши экспериментальные и клинические данные свидетельствуют о необходимости и эффективности применения внутрипеченочной стимуляции регенерации биоматериалом Аллоплант при лечении хронического активного гепатита и цирроза печени и оценки электрокинетических характеристик эритроцитов для диагностики и контроля эффективности лечения данных больных.
Заключение
Снижение электрокинетических свойств эритроцитов служит чутким индикатором наличия активного воспалительного процесса в ранних стадиях хронических диффузных заболеваний печени или при их латентном течении и является наряду с отрицательной динамикой результатов биохимических, биофизических и иммунологических исследований показанием к хирургическому лечению хронического активного гепатита и цирроза печени.
Воздействуя фармакологически на эритроциты, можно достичь улучшения их реологических свойств и отдачи кислорода гепатоцитам, создавая тем самым лучшие условия для регенерации печеночной ткани.
В ходе создания множественных внутрипеченочных депо аллотрансплантата в эксперименте выявлено его выраженное стимулирующее действие на регенерацию паренхимы печени и резорбцию соединительной ткани.
Множественная внутрипеченочная стимуляция регенерации печени биостимулятором Аллоплант является малотравматичным и патогенетически обоснованным способом восстановления морфо-функционального состояния печени.
Изучение ближайших и отдаленных результатов применения внутрипеченочной стимуляции регенерации печени в комплексе хирургического лечения выявило его эффективность на стадии перехода хронического активного гепатита в цирроз печени, а также в его компенсированной и даже субкомпенсированной стадиях.
Практические рекомендации
При постановке показаний к хирургическому лечению хронического активного гепатита и цирроза печени, и оценке его эффективности, наряду с результатами других диагностических методов необходимо учитывать и динамику электрофоретических показателей эритроцитов.
Комплекс оперативного лечения при хронических диффузных заболеваниях печени должен включать операции, направленные на улучшение печеночно-воротного кровообращения, снижение аутоиммуноагресии, стимуляции регенерации печеночной паренхимы.
С целью стимуляции регенерации при хирургическом лечении хронического активного гепатита и цирроза печени считаем необходимым рекомендовать создание множественных внутрипеченочных депо биостимулятора Аллоплант.
Для создания лучших условий протекания репаративных процессов при циррозе печени показано фармакологическое (воздействие на эритроциты с целью улучшения их кислород-транспортных свойств.
Необходимо внедрить в комплекс обследования лиц, работающих в нефтехимической отрасли и на других токсических производствах, а также перенесших любую форму гепатита или имеющих "малый печеночный симптомокомплекс", болеющих хроническим активным гепатитом и циррозом печени, определение электрокинетических свойств эритроцитов как скрининг-тест для выявления поражения печени и определения степени активности воспалительного процесса.
Литература
1. Электрокинетические характеристики эритроцитов у лиц со злокачественными заболеваниями II Электрофорез клетки: Тез. докл.-Уфа, 1987.-С.26-27 (Мингазов Р.С. с соавт.).
2. Некоторые аспекты диагностики и хирургического лечения хронического активного гепатита и цирроза печени // Здравоохранение Башкортостана. - Уфа,1992.- N 2.-С.32-37 (Мингазов Р.С. с соавт.).
3. Применение низкоэнергетических лазеров в комплексном лечении диффузных заболеваний печени // Применение низкоинтенсивных лазеров в экспериментальной и клин. медицине: Тез. докл. науч.-практ. конф,-Ижевск,1994.-С. 109-111 (Мингазов Р.С. с соавт.).
4. Клинико-экспериментальное обоснование применения биологического материала Аллоплант в хирургической гепатологии //Роль иммунологических препаратов в современной медицине; Тез. докл. - Уфа,1995.-С.125-128 (Мингазов Р.С. с соавт.).
5. Механизм стимуляции регенерации печеночной паренхимы при хирургическом лечении циррозов печени с применением аллотрансплантата для стимуляции регенерации // Роль иммунологических препаратов в современной медицине: Тез. докл. - Уфа,1995.-С.145-148(Мингазов Р.С. с соавт.).
6. Применение внутрипеченочной очаговой стимуляции регенерации для лечения циррозов печени // Новые технологии в хирургической гепатологии: Тездокл. 3-й конф. хирургов-гепатологов.-Санкт-Петербург,1995.-С.450-451 (Мингазов Р.С. с соавт.).
7. Малоинвазивная хирургия в лечении диффузных поражений печени // Проблемы клинической медицины: Тез, докл.-Уфа, 1996.-С.94-95 (Мингазов Р.С. с соавт.),
8. Способ пункционного лечения непаразитарных кист печени // Изобретение N94011821/14 (Мингазов Р.С. с соавт.).
к содержанию | опубликовать статью
Экспериментально-клиническое обоснование органосохраняющих операций при травматических повреждениях селезенки у детей с применением биоматериалов Аллоплант (экспериментально-клиническое исследование)
Валитов И.О.
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования "Башкирский государственный медицинский университет Минздрава Российской Федерации"
Впервые в эксперименте доказано, что использование биоматериалов Аллоплант при травматических повреждениях селезенки ускоряет процессы регенерации в поврежденном органе. Впервые в эксперименте изучены гемостатические и пластические свойства указанных биоматериалов при травматических повреждениях селезенки. В детской хирургической практике с целью восстановления целостности поврежденной селезенки при органосохраняющих операциях применены биоматериалы серии Аллоплант производства лаборатории трансплантатов Всероссийского центра глазной и пластической хирургии (г.Уфа).
Актуальность
При закрытой травме живота у детей, среди всех повреждений органов брюшной полости, разрывы селезенки, составляют от 30 до 50 % [Епифанов Н.С., 1992; Розинов В.М., 1994; Баиров Г.А., 1997; Дронов А.Ф., 2001]. Необходимость оперативного вмешательства при травме селезенки не вызывает сомнений, однако вопросы хирургической тактики в настоящее время не решаются однозначно. В детской хирургической практике при травматическом повреждении селезенки нередко отдавали предпочтение спленэктомии [Пугачев А.Г. с соавт., 1981; Зубарев П.Н., 1990; Кущ Н.Л. с соавт., 1995; Баиров Г.А., 1997], недооценивая функциональное значение селезенки в организме ребенка.
Лечение больных с травмой селезенки – одна из сложных проблем детской хирургии. Несмотря на совершенствование методов лечения повреждений селезенки, самой частой операцией по-прежнему остается спленэктомия. Неблагоприятный прогноз и высокая частота гнойно-септических осложнений у аспленированных больных [Афендулов С.А., 1995; Гардовскис Я.Л., 1995; Фаязов Р.Р., 2002; Акбулатов Н.А., 2003; Медведев А.И., 2004; Тимербулатов М.В., 2004; Sekikawa T., 1983; Blackwood I., 1988; Demeter J., 1990; Holdsworth R. et al., 1991; Michalski S. et al., 1991; Falco E., 1992], глубокие исследования о роли селезенки в иммунной системе явились причиной поиска новых методов лечения и усовершенствования уже известных. Спленэктомия, выполненная по поводу травмы селезенки у детей, ведет к значительным иммунным нарушениям, снижает сопротивляемость организма к инфекциям, увеличивает число послеоперационных осложнений, вплоть до молниеносного сепсиса, который в 50% случаев может привести к летальному исходу [Епифанов Н.С.,1991; Розинов В.М.,1994; Кущ Н.Л., 1995; Patel J., Williams J., 1982]. С учетом этих данных изменилось отношение к селезенке и при ее травматическом повреждении у детей, стали чаще выполняться органосохраняющие операции [Горбунов Н.Ю., 1990; Дронов А.Ф., 1998, 2001; Пилипенко А.П., 1998; Смирнов А.Н., 2002; Шкильнюк П.Г., 2002; Урман М.Г., 2003], при этом применяли разнообразные швы, биологические и синтетические материалы [Лимончиков С.П., 1994; Дронов А.Ф., 1997; Каганов Б.С., 1997; Литвин А.А., 2000; Шуркалин Б.К., 2000; Цыбуляк Г.Н., 2001], выполняли резекцию органа [Маховский В.З., 2001] и прибегали к спленэктомии только как к вынужденной операции.
В последние годы широкое применение во многих областях хирургии нашли аллогенные материалы серии Аллоплант. Всероссийским центром глазной и пластической хирургии (г. Уфа, директор Центра – д.м.н., проф. Э.Р.Мулдашев) разработана и внедрена в медицинскую практику серия пластических материалов – "Аллотрансплантаты для хирургии" с товарной маркой Аллоплант, которая утверждена МЗ РФ (рег. удостоверение № 29/10081201/3584-02 от 22.05.2002 г.) . Исследованиями Э.Р.Мулдашева (1974, 1975, 1984, 1993), Р.Т.Нигматуллина (1979, 1986, 1994), А.Г.Габбасова (1981, 1992), Р.А.Хасанова (1999), С.А.Муслимова (2000) показано, что восстановление соединительно-тканных структур при пересадке биоматериалов серии Аллоплант происходит за счет стимуляции механизмов репаративной регенерации по заместительному типу. Анализ клинико-экспериментальных исследований показал, что коллагенсодержащий биоматериал Аллоплант обладает гемостатическими, адгезивными, низкими антигенными свойствами, устойчив к инфекции. В этом пластическом материале сочетаются такие положительные качества, как хорошая моделируемость, простота консервации и способность длительной консервации. Указанные литературные данные позволили выбрать биоматериал Аллоплант для разработки органосохраняющих операций. Учитывая, что техника оперативных вмешательств при травме селезенки может быть различной в зависимости от характера и объема повреждения органа, мы использовали три вида биоматериала Аллоплант: 1) биоматериал для замещения объемных дефектов тканей (ТУ 42-2-537-2002); 2) порошкообразный "стимулятор регенерации" (ТУ 42-2-537-2002); 3) аллосухожильные нити (ТУ 9431-001-27701282-2002). В указанных выше технических условиях дается подробная характеристика биопластических свойств данных препаратов.
Несмотря на то, что повреждения селезенки у детей встречаются довольно часто, многие вопросы хирургического лечения до настоящего времени остаются не решенными. Это касается техники органосохраняющих операций, показаний к применению того или иного вмешательства. Недостаточно освещены морфологические изменения в оперированном органе, не нашли отражения непосредственные и отдаленные результаты органосохраняющих операций в плане оценки анатомического и функционального состояния оперированного органа. В этой связи актуальной задачей является разработка новых методов органосохраняющих операций при травматических повреждениях селезенки у детей.
Цель исследования
Экспериментальное и клиническое обоснование органосохраняющей операции при травматических повреждениях селезенки у детей с применением биоматериалов.
Материалы и методы исследования
Диссертационная работа представляет собой экспериментально-клиническое исследование.
Экспериментальная часть проведена на 28 беспородных собаках, которым проведены оперативные пособия на селезенке. Для решения задач нами была проведена серия экспериментов с моделированием травматических повреждений селезенки и восстановления ее целостности с применением препаратов Аллоплант (I группа) и без данного препарата (II группа), а также морфологическими исследованиями травмированного участка в различные сроки после оперативного вмешательства. Сроки исследования материала были определены с учетом литературных данных об основных регенераторных этапах (Кузин М.И., 1981; Серов В.В., 1995). Целью данного исследования явилось изучение морфологических изменений и процесса регенерации ткани селезенки, восстановления в ней кровообращения и взаимоотношений биоматериала с функциональными зонами селезенки. При этом решались следующие вопросы: а) Изучить состояние стромы и особенностей изменения кровообращения травмированного участка селезенки в различные сроки. б) Изучить дистрофические и некробиотические изменения травмированного участка селезенки с учетом клеточных взаимоотношений в функциональных зонах селезенки в ответ на применение биоматериала Аллоплант. в) Сравнить регенеративные процессы в ране селезенки при применении Аллопланта (I группа) и без применения биоматериала (II группа) в разные сроки.
Нами разработан в эксперименте новый способ восстановления целостности травмированной селезенки с применением комплекса препаратов серии Аллоплант: 1) биоматериал для замещения объемных дефектов тканей (ТУ 42-2-537-2002); 2) порошкообразный "стимулятор регенерации" (ТУ 42-2-537-2002); 3) аллосухожильные нити (ТУ 9431-001-27701282-2002).
Операция заключалась в следующем: под общим обезболиванием после обработки операционного поля производили верхнесрединную лапаротомию. Селезенку, средние размеры которой были 12 х 7 х 2 см, из левого поддиафрагмального пространства выводили в рану, на диафрагмальной поверхности наносили острую травму скальпелем, длина разрыва колебалась от 5 до 7 см, а глубина до 1,0 -1,5 см, т.е. моделировалось глубокое и длинное повреждение относительно селезенки собаки. После нанесения травмы наблюдалось обильное кровотечение, объем кровопотери достигал от 10,0-15,0 мл до 50,0-60,0 мл. Гемостаз и восстановление целостности травмированной селезенки достигали следующим образом: в ложе раны укладывали препарат Аллоплант (биоматериал для замещения объемных дефектов тканей), моделированный соответственно форме и размерам раны, накладывали на всю глубину раны швы аллосухожильными нитями с интервалом 1,0 - 1,5 см. После ушивания раны таким способом достигался надежный гемостаз. С целью ускорения процесса регенерации поверх шва производили обработку порошкообразным препаратом Аллоплант. Рана брюшной стенки ушивалась послойно обычным способом.
Вторая группа экспериментальных животных оперирована без применения Аллопланта. Гемостаз поврежденной селезенки производился стандартно наложением на рану кетгутовых или капроновых швов.
Для гистологической проводки брали кусочки тканей в зоне ушивания раны травмированной селезенки размерами 1,5 х 2,0 см. Кусочки были фиксированы в 10% нейтральном формалине, после спиртовой проводки и заливки в парафин изготовляли гистологические срезы толщиной в 5-7 микрон. Окраска гематоксилин-эозином использовалась для визуальной оценки гистологических изменений в органе и для подсчета площадей всех функциональных зон лимфоидной ткани селезенки. Всего нами приготовлено и изучено более 350 гистологических препаратов.
В селезеночной ткани изучались следующие показатели: площади белой и красной пульпы, количество фолликулов, по всем функциональным зонам белой и красной пульпы проводился количественный анализ кариоцитов, макрофагов и погибающих клеток, лимфоидных элементов, гистиоцитов. Количественный анализ плотности клеток проводился относительно площади функциональных зон. При этом анализировали не только количество плазматических элементов, а также уточняли их зрелость. Полученные цифровые данные были подвергнуты статистической обработке, в основу которой взят закон нормального распределения вариант. Использовался параметрический метод оценки достоверности результатов (вариационный анализ) (Автандимов Г.Г., 1980), который допустим при любом количестве наблюдений n > 1. Для статистического анализа полученных данных по каждому вариационному ряду, соответствующему показателям одной серии животных, подсчитывали среднюю арифметическую (М), стандартную ошибку средней арифметической (m). Для сравнения средних величин применялся критерий t Стьюдента, позволяющий установить статистическую значимость разницы (р). Достоверными считались результаты при р£ 0,05, что является допустимым в медико-биологических исследованиях.
Клинический материал включает 87 пострадавших детей с травмами селезенки, из них 85 (97,7%) – закрытые повреждения, 2 (2,3%) – открытые ранения, находившихся на лечении в детских хирургических отделениях ГДКБ № 17 г. Уфы и РДКБ за период с 1996 по 2003 год. Наибольшую группу пострадавших составляют дети среднего школьного возраста, средний возраст составил 10,32 ± 2,13 лет. Из общего числа пострадавших 64 (73,6%) составили мальчики, 23 (26,4%) – девочки. Оперативное пособие проведено 80 детям (92,0%), 7 (8,0%) пациентов пролечено консервативно. Причиной повреждения селезенки у 41 ребенка (47,12%) была автодорожная травма. Несколько меньше – падение с высоты: 36 случаев (41,37%), 8 пострадавших (9,19%) получили травму во время спортивных тренировок, 2 пациента (2,3%) были оперированы после проникающего ранения брюшной полости с повреждением селезенки. По характеру повреждений мы выделили группы больных с изолированной 34 (39,08%) и сочетанной53 (60,92%) травмой селезенки.
Умерло 3 больных с сочетанными травмами, у которых наряду с повреждением селезенки имелись тяжелая черепно-мозговая травма, повреждения внутренних органов других локализаций, множественные переломы костей конечностей и таза, некупированный шок. Летальность составила 3,4%.
Пострадавшим детям с повреждениями селезенки проводилось комплексное обследование, включающее клинические, лабораторные и инструментальные методы исследований по разработанной схеме лечебно-диагностического алгоритма.
Из лабораторных показателей имели значение: общий анализ крови с лейкоформулой и тромбоцитами, общий анализ мочи, биохимические анализы (общий белок, креатинин, печеночные пробы, мочевина, глюкоза, амилаза), иммунограмма, амилаза мочи.
Инструментальные методы включали в себя рентгенологические исследования органов брюшной полости, грудной клетки, черепа, позвоночника, костей таза и конечностей, а также экскреторная урография.
Компьютерная томография (КТ) брюшной полости (рис. 1), головного мозга проводилась детям с травмами селезенки при тяжелых ситуациях ранней диагностики, а также в послеоперационном периоде – 18 больным (20,7%).
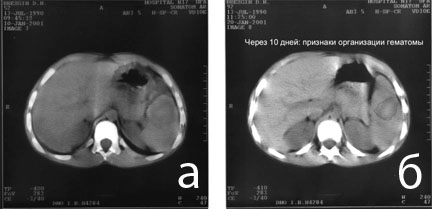
Рис. 1. Компьтерная томография органов брюшной полости в острой стадии и через 10 дней после травмы
УЗИ брюшной полости широко использовалось на этапе ранней диагностики (рис 2 а,б): у 28 пациентов (32,2%) диагноз повреждения селезенки был выставлен до хирургического вмешательства. Ультразвуковое исследование широко использовалось в послеоперационном периоде, при помощи которого проводилось динамическое наблюдение за процессом регенерации селезенки и на наличие послеоперационных осложнений.
Рис. 2. Ультразвуковая картина повреждения селезенки. Свободная кровь в полости малого таза (а), периспленальная гематома (б)
Большое значение в диагностике имели лапароцентез и диагностическая лапароскопия. Лапароцентез как наиболее простой и доступный метод применен нами у 38 (43,7%) больных, а лапароскопия - 23 (26,4%) пациентам.
Результаты исследования и их обсуждение
Экспериментальная часть. Экспериментальные исследования проведены на 28 собаках по разработанному методу (приоритетная справка Российского агентства по патентам и товарным знакам о выдаче патента РФ на изобретение по заявке № 2004104574/14 от 16.02.2004 г.). В эксперименте на собаках после нанесения травмы отмечалось образование достаточно глубокого дефекта паренхимы органа, гематомы с краевым некрозом в толще селезенки и массивное кровотечение из краев раны. Производилось прошивание крупных питающих сосудов, закрытие травматического дефекта биоматериалом, окончательным этапом операции было ушивание краев раны аллосухожильными нитями и обработка ушитой раны порошкообразным Аллоплантом.
Повторно экспериментальных животных оперировали через 7, 14, 21 28 дней после первой операции, производилась резекция селезенки с целью забора материала для гистологических исследований. Проведен сравнительный анализ морфологических изменений в ответ на хирургическое вмешательство в 2 группах: I) ушивание раны селезенки с применением материалов серии Аллоплант, II) ушивание традиционным способом (кетгут, капрон) без биоматериалов. Для контроля исследована интактная (здоровая) селезенка собак.
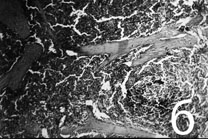
Рис. 3. Морфологическая картина изменений в поврежденном участке через 7 дней после операции. а – с применением биоматериала Аллоплант б – без применения биоматериала Аллоплант
В нашем эксперименте в ранние сроки (7-14 сутки) после имплантации Аллопланта в окружающих тканях (I группа животных) наблюдались: расширение венозного отдела микроциркуляторного русла, агрегация эритроцитов и стаз крови в просвете сосудов (табл.1).
| Серии | 7 суток | 14 суток | 21 сутки | 28 сутки |
|---|---|---|---|---|
| с применением Аллопланта (I группа) | 1.39 ± 0.18* | *2.34 ± 0.14* | 2.12±0.12 | 1.72± 0.15* |
| без применения Аллопланта (II группа) | *0.96 ± 0.11 | 1.55 ± 0.21 | 2.09± 0.13 | *2.28± 0.08 |
| Контроль - 1,75±0,22 | ||||
Обнаруживалась незначительная клеточная инфильтрация с преобладанием полиморфноядерных лейкоцитов и макрофагов (табл.3,4), что позволяет расценивать указанные явления как реакцию на операционную травму. По периферии Аллопланта наблюдались плазморагия, пропитывание пучков коллагеновых волокон и слабое набухание их. В дальнейшем зона гомогенизации коллагеновых волокон Аллопланта увеличивалась, а в периферических участках наблюдалась инвазия макрофагов, внутрь пораженной зоны фагоцитировали лизированные фрагменты Аллопланта. В этих же участках Аллопланта наблюдались скопления фибробластов, мигрирующих по ходу коллагеновых волокон, наблюдались признаки новообразования капилляров (рис. 3 а, б). Изменения в те же сроки отмечались и во II группе экспериментальных наблюдений, но они носили характер более массивного и длительного повреждения (табл.2).
| 7 сутки | 14 сутки | 21 сутки | 28 сутки | |
|---|---|---|---|---|
| I группа (основная) - опыты с применением Аллопланта | ||||
| Красная пульпа | 162,4±6,2* | 183,2±4,1* | 161,9±3,8* | *148,7±5,1* |
| фолликулы | *142,4±5,7 | *133,2±3,5* | 185,2±4,6* | 178,2±3,9* |
| II группа - опыты без применения Аллопланта | ||||
| Красная пульпа | *114,3±3,2 | *107,4±4,3 | *127,2±3,5 | *212,7±7,5 |
| фолликулы | *138,5±3,8 | *101,5±2,8 | *96,3±2,9 | *145,8±5,2 |
| Интактная группа (контроль) | ||||
| Красная пульпа | 171,6±4,2 | |||
| фолликулы | 183,8±3,9 | |||
Примечание: символ * до числового значения – достоверная разница (р<0,05) с контрольной группой; символ * после числового значения – достоверная разница (р<0,05) между I и II группой
В последующие сроки (21-28 сутки) указанные процессы затрагивали всю толщу биоматериала и в процесс резорбции были вовлечены большие участки Аллопланта. Соответственно увеличивался и объем регенерирующего ретикулярного каркаса, который начинал формироваться на месте резорбированных фрагментов биоматериала. В этих фрагментах обнаруживались новообразованные коллагеновые и ретикулярные волокна с характерными тинкториальными свойствами. Архитектоника новообразованных волокон и формирующихся трабекул повторяла таковую трансплантата, так как лизируемые макрофагами коллагеновые фибриллы синхронно замещались новообразованными. Когда процессы резорбции трансплантата и регенерации красной пульпы и частично фолликулов достигали своего максимума (табл. 1,3,4) на гистологических препаратах уже было трудно дифференцировать границы имплантированного биоматериала и новообразованной ткани (рис. 4 а, б).
Рис. 4. Морфологическая картина изменений в поврежденном участке через 28 дней после операции. а – с применением Аллопланта (формирование мешковидных трабекулярных выростов); б – без применения Аллопланта (разрастание соединительной ткани с переходом в рубцовую)
| Серии эксперимента | Сроки | |||
|---|---|---|---|---|
| 7 сутки | 14 сутки | 21 сутки | 28 сутки | |
| I группа (с применением Аллопланта) | *6,8±0,2 | *4,2±0,25* | *3,7±0,1 | *4,5±0,2* |
| II группа (без применения Аллопланта) | *7,0±0,1 | *3,3±0,2 | *3,5±0,3 | *3,9±0,2 |
| Контрольная группа | 5,6±0,4 | |||
| Серии эксперимента | Сроки | |||
|---|---|---|---|---|
| 7 сутки | 14 сутки | 21 сутки | 28 сутки | |
| I группа (с применением Аллопланта) | *5,70,3* | *7,00,5* | *5,50,2* | 4,40,2* |
| II группа (без применения Аллопланта) | *6,70,2 | *8,30,1 | *7,90,2 | *6,30,4 |
| Контрольная группа | 4,20,3 | |||
Примечание: символ * до числового значения – достоверная разница (р<0,05) с контрольной группой; символ * после числового значения – достоверная разница (р<0,05) между I и II группой
При изучении характерных особенностей влияния Аллопланта в посттравматическом периоде установлены преимущества его применения в виде: а) сокращения сроков проявлений повреждения; б) характер регенерации был физиологический, что существенно отличает его от оперативного пособия без применения Аллопланта, где идет цирротический тип регенерации.
Применение Аллопланта позволило активизировать собственные резервы селезенки: 1) фаза приспособления – повреждение вызвало сокращение объема фолликулов, под воздействием биоматериала антигенная стимуляция была ослаблена, произошло сокращение ретикулярной основы поврежденного участка; 2) фаза компенсации – удлинение трабекулярного остова селезенки позволило отграничить поврежденный участок, макрофагальные активированные процессы уменьшили зону некроза и резорбировали остатки биоматериала; 3) фаза восстановления – к парацентральным артериям селезенки мигрируют лимфоидные клетки, которые формируют за счет клеточных взаимосвязей конгломераты фолликулов, при этом Т-центры начинают реагировать на окружающие раздражители.
Изучение морфологического строения травмированной селезенки в динамике в течение одного месяца опыта показывает, что происходит практически полное восстановление селезеночной ткани в травмированном участке и реакция резорбции биологического материала (I группа).
Результаты клинических исследований
Из 87 находившихся на лечении больных с травмой селезенки были оперированы 80 детей (91,9%), а семи пациентам (8,1%) проведено консервативное лечение. Из 80 оперированных больных у 29 (36,2 %) было произведено удаление поврежденной селезенки (табл. 5). Показаниями к спленэктомии явились следующие ее повреждения: отрыв селезенки от сосудистой ножки и повреждение селезеночной вены; размозжение или фрагментация селезенки; множественные чрескапсулярные разрывы; локализация ран селезенки в труднодоступных для вмеша¬тельств областях (на диафрагмальной поверхности, в области зад¬него края, верхнего полюса или ворот); крайне тяжелое состояние постра¬давшего, когда решаются вопросы жизни; безуспешность достижения гемостаза и восстановления целостности селезенки, а также усиление кровотече¬ния. Из 29 спленэктомированных больных у 18 удаление селезенки было выполнено сразу, у 11 – только после безуспешной попытки достижения надежного гемостаза различными способами.
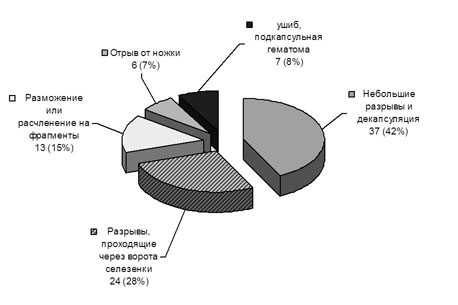
Рис. 5. Структура повреждений селезенки
| Оперативные вмешательства | Закрытые повреждения | Открытые повреждения | Всего | ||
|---|---|---|---|---|---|
| изолированные | сочетанные | изолированные | сочетанные | ||
| 1. Диагностическая лапароскопия (в т.ч. лечебных) | 19 | 3 | 1 | - | 23(7) |
| 2. Спленэктомия | 11 | 18 | - | - | 29 |
| 3. Органосохраняющие операции | 16 | 34 | 1 | - | 51 |
| – ушивание селезенки традиционным способом | 7 | 7 | - | - | 14 |
| – ушивание раны с аппликацией "Тахокомба" | 3 | 13 | - | - | 16 |
| – ушивание раны с применением препаратов Аллоплант | 6 | 14 | 1 | - | 21 |
У 51 больного (63,7%) произведена органосохраняющая операция. Показаниями к сохранению селезенки служили такие случаи, когда:
- рана селезенки была поверхностной;
- рана селезенки была обширной, но без повреждения сосудистой ножки и доступной для вмешательства;
- состояние больного позволяло произвести более длительную операцию на селезенке;
- имелась уверенность в достижении надежного гемостаза.
У 14 пациентов кровотечение остановлено ушиванием раны на селезенке, в ряде случаев в сочетании с оментопексией. В 16 случаях – сочетанием спленорафии с аппликацией пластиной "Тахокомба". У больных этой группы единичные чрескапсулярные разрывы локализовались чаще всего на висцеральной поверхности, в области ворот селезенки. Применение "Тахокомба" мы считаем оправданным в тех случаях, когда: а) рана селезенки поверхностная, глубиной до 1,0 см б) протяженность раны не превышает 4,0-5,0 см в) раневая поверхность селезенки "сухая" и нет опасности скопления гематомы под пластиной "Тахокомба". Недостатком этого метода можно считать ненадежность при выраженном кровотечении, необходимость создания сухой поверхности для фиксации пластины к ране. В одном случае отмечалось послеоперационное осложнение в виде вторичного кровотечения из раны селезенки, потребовавшее релапаротомии через сутки после операции. Поэтому мы применяли "Тахокомб" в сочетании с ушиванием раны селезенки.
У 21 оперированных больных гемостаз достигнут ушиванием разрыва селезенки аллосухожильными нитями с применением губчатого и порошкообразного Аллопланта. У большинства больных, перенесших органосохраняющие операции, разрывы селезенки локализовывались преимущественно на висцеральной поверхности, в области переднего края или нижнего полюса органа, лишь в 8-ми случаях имелось повреждение в области ворот селезенки и в 5-ти случаях разрывы отмечались на диафрагмальной поверхности органа. У данной категории больных органосохраняющие операции выполнялись после мобилизации селезенки на сосудистой ножке вместе с хвостом поджелудочной железы. После лапаротомии, ревизии органов брюшной полости и установления локализации травматического разрыва селезенки приступали к гемостазу и восстановлению ее целостности. В ложе раны укладывали губчатый препарат Аллоплант, моделируя его соответственно форме и размерам раны, затем накладывали на всю глубину раны швы нитями Аллопланта с интервалом 1,0 1,5 см. Таким образом, достигался надежный гемостаз. С целью стимуляции процесса регенерации раны поверх шва производили обработку порошкообразным препаратом Аллоплант. После этого селезенку укладывали в свое ложе, фиксируя 2-3 швами к париетальной брюшине. Рана брюшной стенки ушивалась послойными швами.
Исходя из вышеизложенного считаем, что наиболее оптимальным вариантом гемостаза и восстановления целостности поврежденной селезенки является применение разработанного нами способа ушивания и обработки раны селезенки с применением биоматериалов серии Аллоплант.
Таким образом, самой частой операцией, которую мы выполняли при повреждениях селезенки, была органосохраняющая. Органосохраняющие операции на селезенке с использованием традиционных оперативных до¬ступов и методов гемостаза были возможны при небольших по глубине и доступных для вмешательства локализациях повреждений с умеренно выраженным кровотечением. Особые технические трудности для выполнения органосохраняющих операций на селезенке представля¬ли больные, у которых разрыв локализовался на диафрагмальной по¬верхности, в области заднего края, верхнего полюса или ворот органа. Труднодоступные локализации повреждений селезенки мы нашли у 18 (62,1%) спленэктомированных больных. До недавнего времени при таких травмах селезенки выполняли спленэктомию. Haш опыт показал, что в этих случаях возможно выполнение органосохраняющей операции лишь при условии полной мобилиза¬ции селезенки на сосудистой ножке вместе с хвостом поджелудочной железы и выведения ее в лапаротомную рану. Для этого необходимо рас¬сечь желудочно-селезеночную, подвешивающую, ободочно-селезеночную и задний листок диафрагмально-селезеночной связки. Первые три связки следует рассекать на зажимах и лигировать. После этого селезенка может быть выведена в операционную рану путем тупого мануального выделения. Окончательный гемостаз должен достигаться наиболее приемлемым и эффективным в каждом конкретном случае способом.
В послеоперационном периоде осложнения различной выраженности возникли у 17 (19,5%) больных, большей частью у пострадавших с сочетанной и множественной травмой селезенки – 12 (13,8%). У травмированных детей с изолированными повреждениями селезенки послеоперационные осложнения были почти в три раза меньше, что составило 4 (4,6%) случаев. После органосохраняющих операций осложнения возникли у 2 детей с изолированными повреждениями и у 5 пострадавших с сочетанными травмами. У перенесших спленэктомию в 10 (11,5%) случаях отмечались различные послеоперационные осложнения. Структура послеоперационных осложнений приведена в таблице (табл. 6).
Среднее пребывание в стационаре в группе больных, перенесших спленэктомию – 19,7 койко-дней, а больных после органосберегательного лечения травмы селезенки составил 17,5 койко-дней (при применении "Тахокомба" – 19,6; при использовании Аллопланта 16,2).
Из 29 спленэктомированных больных умерло 2. Причиной смерти у обоих травмированных были тяжелые сочетанные повреждения (травматический шок, перелом основания черепа, множественные переломы костей конечностей и таза, травмы других органов брюшной полости). Летальность в данной группе больных составила 7,4 %.
| Послеоперационные осложнения | Органосохраняющие операции | Спленэктомия | ||
|---|---|---|---|---|
| сочетанные травмы | изолирован. травмы | сочетанные травмы | изолирован. травмы | |
| Ранняя спаечная непроходимость | - | 1 | 1 | - |
| Перитонит | - | - | 1 | 1 |
| Продолжающееся кровотечение | 1 | - | - | - |
| Нагноение п/о раны | 1 | - | 2 | - |
| Плевролегочные осложнения | 1 | - | 2 | 1 |
| Образование посттравматических кист селезенки | 1 | 1 | - | - |
| Умерло | 1 | - | 2 | - |
| Всего | 7 (8,0%) | 10 (11,5%) | ||
Из 51 больного, которым произведена органосохраняющая операция на селезенке, в одном случае наступил летальный исход, ставший следствием тяжелой сочетанной травмы: черепно-мозговой, травмы внутренних органов и множественных переломов конечностей. Летальность в основной группе составила 1,9%.
Таким образом, широкое использование органосохраняющих операций при травматических повреждениях селезенки у детей позволило нам снизить показатели послеоперационных осложнений в 1,4 раза и послеоперационной летальности в 2 раза.
Заключение
Экспериментальные исследования морфологических изменений и регенеративных процессов в травмированном участке селезенки при применении биоматериалов серии Аллоплант у подопытных животных доказывает, что данный биоматериал обладает хорошими гемостатическими свойствами, резорбируется и замещается васкуляризированной рыхлой соединительной тканью без признаков рубцевания через 3-4 недели после операции.
На основе проведенных экспериментальных исследований нами разработан новый оригинальный способ гемостаза и восстановления целостности поврежденной селезенки с использованием препаратов серии Аллоплант при ее травматических повреждениях.
При травматических повреждениях селезенки у детей с учетом ее функционального значения методом выбора является щадящая органосохраняющая операция. При глубоких и обширных ранах селезенки следует применять разработанный нами в эксперименте и прошедший клиническое испытание новый метод восстановления ее целостности с использованием биоматериалов Аллоплант. Применение указанного метода показало значительные его преимущества по сравнению с традиционными способами (ушивание, апликации пластиной "Тахокомба", оментопексия и т.д.). При этом достигается надежный гемостаз, ускоряются сроки заживления раны селезенки, исключаются осложнения со стороны брюшной полости.
Клиническое использование разработанного нами нового метода позволило уменьшить послеоперационные осложнения в 1,4 раза, сократить время пребывания больных в стационаре по сравнению с традиционными методами гемостаза.
Практические рекомендации
При травматических разрывах селезенки у детей считаем необходимым производить щадящие органосохраняющие операции. Оптимальным способом является использование при ушивании травматических разрывов селезенки биоматериалов серии Аллоплант, которые обеспечивают надежный гемостаз, прочное удержание краев раны селезенки и стимулируют процесс заживления. Применение биоматериалов расширяет показания к применению органосохраняющих операций и может быть использовано в клинической практике как при изолированных, так и при множественных глубоких повреждениях селезенки. При поверхностных и небольших повреждениях необходимо ушивание раны с аппликацией пластины "Тахокомба".
Показаниями к органосохраняющим операциям при травматических повреждениях селезенки у детей считаем поверхностные ее разрывы, а также глубокие разрывы органа без повреждения сосудистой "ножки" и колото-резаные раны селезенки.
Противопоказаниями к органосохраняющим операциям при травмах селезенки считаем полное размозжение селезенки; отрыв ее от сосудистой "ножки"; повреждение селезенки в сочетании с разрывом полого органа; шок тяжелой степени любой этиологии (травматический, геморрагический и др.); невозможность достижения надежного гемостаза (нарушения свертывающей системы, безуспешность гемостатических мероприятий и т.д.).
В диагностике и оказании помощи при травме живота необходимо придерживаться разработанного нами лечебно-диагностического алгоритма: УЗИ, лапароскопия (лапароцентез), компьютерная томография. Применение ультразвуковой диагностики позволяет определить наличие и локализацию травматических разрывов и гематом селезенки, количество свободной жидкости в брюшной полости, а также повреждение других органов живота и забрюшинного пространства. Диагностическая лапароскопия является наиболее информативным методом диагностики, позволяющим визуально оценить состояние внутренних органов и структур, идентифицировать характер повреждения. Диагностическая лапароскопия при некоторых ситуациях может стать лечебной манипуляцией, при которой возможна остановка кровотечения путем коагуляции, тампонирования раны селезенки гемостатическим материалом, а также проведении санации и дренировании брюшной полости. Компьютерная томография, обладающая высокой информативностью в диагностике повреждений паренхиматозных органов, показана при стабильной гемодинамике больного. При признаках угрожающего кровотечения, развитии геморрагического шока, подозрении на повреждение полого органа рекомендуем производить широкую лапаротомию. В случае выявления травматического разрыва селезенки необходимо придерживаться тактики органосохраняющих операций по показаниям.
Литература
1. Применение препарата "Тахокомб" при травматических разрывах паренхиматозных органов у детей // Современные достижения детской хирургии: Материалы республиканской конференции, посвященной 30-летию кафедры детской хирургии МГМИ. – Минск, 1999. – С.191-192. (Соавт. Юлдашев М.Т., Ахмадеев Р.И.).
2. Новый способ хирургического лечения травматических разрывов паренхиматозных органов с применением аллопластических материалов в эксперименте // Вопросы пластической, реконструктивной хирургии и клинической анатомии: СБ. научных трудов. – Томск, 2000. – Выпуск I. – С.253-256.(Соавт. Юлдашев М.Т., Ахмадеев Р.И., Булыгин Л.Г., Юлдашев С.М.).
3. Экспериментальное обоснование органосохраняющей операции при травматических повреждениях селезенки с применением аллопластических материалов // Материалы конференции, посвященной 65-летию кафедры оперативной хирургии и хирургической анатомии. – Уфа: Здравоохранение Башкортостана, 2000. – С.13. (Соавт. Юлдашев М.Т., Булыгин Л.Г., Ахмадеев Р.И.).
4. Новый способ хирургического лечения травматических разрывов паренхиматозных органов с применением аллопластических материалов в эксперименте // Материалы конференции, посвященной 65-летию кафедры оперативной хирургии и хирургической анатомии. – Уфа: Здравоохранение Башкортостана, 2000. – С.32-33. (Соавт. Юлдашев М.Т., Булыгин Л.Г., Ахмадеев Р.И., Юлдашев С.М.).
5. Применение препарата "Тахокомб" при травматических разрывах паренхиматозных органов у детей // Материалы конференции, посвященной 65-летию кафедры оперативной хирургии и хирургической анатомии. – Уфа: Здравоохранение Башкортостана, 2000. – С.98. (Соавт. Юлдашев М.Т., Юлдашев С.М., Ахмадеев Р.И., Сурова А.М.).
6. Результаты лечения травматических повреждений органов брюшной полости у детей по материалам ГДКБ №17 г. Уфы // Материалы конференции, посвященной 65-летию кафедры оперативной хирургии и хирургической анатомии. – Уфа: Здравоохранение Башкортостана, 2000. – С.114-115. (Соавт. Юлдашев М.Т., Каусаров Р.Д., Сурова А.М., Крылова Т.Г., Амиров Р.М., Муравин Л.И.).
7. Ультразвуковая эхография и лапароскопия в комплексе лечебно-диагностических мероприятий при травмах живота у детей // Радиология 2000. Лучевая диагностика и лучевая терапия на пороге третьего тысячелетия: Сб. тезисов. – Москва, 2000. – С.701-702.(Соавт. Юмагулов З.Ш., Чечко С.М., Садретдинов М.М., Сарваров Д.А.)
8. Органосохраняющие операции при травматических повреждениях селезенки у детей // Здравоохранение Башкортостана. – 2001. – Т.5, №1. – С.41-42. (Соавт. Юлдашев М.Т.).
9. Органосохраняющие операции при травматических повреждениях селезенки у детей // Современные проблемы механического шва в хирургии: Сб. науч. трудов, посвященный 75-летию проф. О.С.Кушаковского / Под ред. проф. А.В. Чукичева. – Челябинск: Изд-во "Челябинская государственная медицинская академия", 2001. – С.50-53. (Соавт. Юлдашев М.Т.)
10. Лапароскопические органосохраняющие операции при травме селезенки у детей // Эндоскопическая хирургия. – 2001. - №3. – С.24-25. (Соавт. Алянгин В.Г., Юлдашев М.Т., Тыртышная Л.В., Ихсанов М.З.).
11. Аллоплант в регенерации травмированной селезенки у детей // Морфология. – 2002. - №2-3. – С.30. (Соавт. Юлдашев М.Т., Валеева Г.Р., Амиров Р.М.).
12. Экспериментально-клиническое обоснование органосберегающих операций при травматичесих повреждениях селезенки // Новые технологии в хирургии. Здравоохранение Башкортостана. – 2004. - №3. – С.50. (Соавт. Юлдашев С.М., Султанова Г.Р., Булыгин Л.Г., Юлдашев М.Т.).
ИЗОБРЕТЕНИЯ И РАЦИОНАЛИЗАТОРСКИЕ ПРЕДЛОЖЕНИЯ
1. Способ восстановления целостности паренхиматозных органов при их травматических повреждениях у детей // Приоритетная справка Российского агентства по патентам и товарным знакам о выдаче патента РФ на изобретение по заявке № 2004104574/14 от 16.02.2004 г. (соавт. Юлдашев М.Т., Султанова Г.Р., Юлдашев С.М., Ахмадеев Р.И., Булыгин Л.Г.).
2. Способ наложения гемостатического шва Петрова для ушивания ран паренхиматозных органов // Удостоверение на рационализаторское предложение № 2107 от 16.09.1999 г., выданное Башкирским государственным медицинским университетом (соавт. Булыгин Л.Г., Юлдашев М.Т., Ахмадеев Р.И., Мирхайдаров А.Р.).
3. Способ ушивания ран и остановки кровотечения при травматических разрывах паренхиматозных органов // Удостоверение на рационализаторское предложение № 2108 от 16.09.1999 г., выданное Башкирским государственным медицинским университетом (соавт. Юлдашев М.Т., Сурова А.М., Ахмадеев Р.И.).
4. Способ хирургического лечения при травматических разрывах паренхиматозных органов у детей // Удостоверение на рационализаторское предложение № 2691 от 25.11.2003 г., выданное Башкирским государственным медицинским университетом (соавт. Юлдашев М.Т., Султанова Г.Р., Юлдашев С.М., Ахмадеев Р.И., Булыгин Л.Г.).
к содержанию | опубликовать статью
ЗАМЕЩЕНИЕ ТУБЕРКУЛЕЗНОЙ ЛЕГОЧНОЙ КАВЕРНЫ БИОМАТЕРИАЛОМ АЛЛОПЛАНТ
Инченко К. С.
Работа выполнена в Московском научно-практическом центре борьбы с туберкулезом Департамента здравоохранения города Москвы, ФГУ «Всероссийский центр глазной и пластической хирургии» Министерства здравоохранения и социального развития Российской Федерации
Впервые изучена в эксперименте возможность применения ксено- и аллогенного биологического материала соединительнотканной природы для закрытия туберкулезных легочных каверн. Изучена динамика морфологических преобразований при закрытии дефекта указанными биоматериалами. Показана возможность применения биоматериала Аллоплант для замещения объемных дефектов тканей во фтизиохирургии.
Актуальность проблемы
Закрытие туберкулезных каверн является одной из наиболее трудных проблем при лечении деструктивных форм туберкулеза легких (Л. К. Богуш, Э. Г. Карапетян, 1981; Т. М. Кариев с соавт., 1985; В. П. Стрельцов с соавт., 1986; В. В. Суслин с соавт., 1987; И. М. Слепуха с соавт., 1987 и др.).
Частота закрытия полостей распада у больных с распространенным деструктивным туберкулезом легких при применении комбинированной антибактериальной терапии не превышает 34-53% (М.В. Шестерина с соавт., 1976; А. Г. Добровольский, 1977; В. А. Адамович, Д.С. Качуровская, 1987), а по другим данным 53—84% (Л. К. Богуш, 1982; А.А. Приймак с соавт., 1985; Е.В. Богатырева, 1987; 3.Д. Репницкая, Е.И. Кильдюшева, 1988).
Специфическая терапия имеет пределы, и от 10 до 25% больных остаются неизлеченными (А. Г. Хоменко, 1980; Н. Я. Драганюк с соавт., 1981; М. Я. Ибрагимова, 1986; А. В. Денисов, П. Ф. Гапонюк, 1988 и др.). Частота закрытия туберкулезных легочных каверн при впервые выявленном процессе меньше частоты прекращения бактериовыделения (А. Д. Куничан, 1985). Существенное влияние на результаты лечения и эпидемиологическую обстановку оказывают хирургические методы. Применение их повышают излечение деструктивного туберкулеза (А. Г. Сычев, 1984). По данным В. П. Стрельцова (1987), удельный вес больных фиброзно-кавернозным туберкулезом, излеченных с помощью хирургических методов, не превышает 7,0-8,2%.
Сохранение остаточной полости даже при отсутствии явного бактериовыделения свидетельствует о незавершенности терапии и значительно увеличивает риск рецидива туберкулеза легких (А. Г. Хоменко, 1980). Ряд авторов отмечает увеличение в последние годы удельного веса рецидивов туберкулеза легких (В. С. Анастасьев, Г. Д. Равдель, 1985; А. С. Соловьева, Г. Н. Бурмистрова, 1987; Н. Г. Урсов с соавт., 1988). По данным Молоткова с соавт. (1986) ежегодно один из шести случаев туберкулеза легких является рецидивом. При этом клиническая структура рецидивов значительно тяжелее, чем у впервые выявленных больных, выше удельный вес бактериовыделителей (Н. Г. Урсов, 1990).
Радикальные оперативные вмешательства из-за наличия сопутствующих заболеваний, низких функциональных показателей и распространенности процесса противопоказаны у 15-20% больных деструктивным туберкулезом. Все это создает определенные трудности в лечении этой группы больных. В связи с этим проблема закрытия туберкулезных легочных каверн сохраняет свою актуальность (М.В. Шестерина, 1980; А.А. Андрейко с соавт., 1985 и др.).
Разрабатываемые в 1960-е—1970-е годы методики закрытия полостей в легких полимеризующимися композициями надежд не оправдали. Несомненный эффект имеют разработанные методики различных модификаций кавернопластики и пластики каверн мышечными лоскутами. Однако в ряде случаев при пластике больших каверн у длительно болеющих больных деструктивным туберкулезом возникают проблемы с пластическим материалом, так как собственных близлежащих тканей оказывается недостаточно для закрытия полости. Хирургов не всегда удовлетворяют существующие методы местного лечения каверны, ввиду наличия у каждого из них ряда недостатков. Это ставит перед исследователями задачи по разработке и поиску новых, более эффективных способов лечения.
В имеющейся литературе недостаточно сообщений об использовании аллогенных биологических материалов соединительнотканной природы для закрытия туберкулезных легочных каверн. Эти материалы должны обладать устойчивостью к инфекции и одновременно стимулировать репаративные процессы в легочной каверне.
Такими свойствами обладает консервированный биологический материал соединительнотканной природы для замещения объемных дефектов тканей, выпускаемый лабораторией консервации тканей Всероссийского центра пластической хирургии глаза. Материал защищен товарным знаком Аллоплант.
Во фтизиохирургии этот материал не применялся, что и явилось основанием для проведения настоящего исследования.
Основной целью данной работы является создание и экспериментальное обоснование нового способа лечения с применением консервированного биологического материала соединительнотканной природы во фтизиохирургии для закрытия туберкулезной легочной каверны.
Материал и методы исследования
Исследования проведены на 57 беспородных собаках обоего пола массой 8—12 кг со сроком наблюдения от 3 до 180 суток. Соответственно с поставленными задачами собаки были распределены на 10 групп, из которых 8 были опытными и 2 контрольными. Материалом исследования служило 426 гистологических препаратов и 116 рентгенограмм.
При выполнении настоящего исследования были применены следующие методы:
1) Патофизиологические методы
а) моделирование дефекта в интактном легком и имплантация ксено- и аллотрансплантатами (рационализаторское предложение № 27 от 27.01.89).
Все операции начинались в условиях операционной после вводного наркоза 1% раствора тиопентала натрия в дозе 1 мл/кг с последующей нейролептаналгезией (дроперидол, фентанил — 0,05% раствором 0,1 мл/кг) с искусственной вентиляцией легких атмосферным воздухом. В V межреберье - справа производилась торакотомия. В рану выводилась правая диафрагмальная доля легкого, в которой сосудистыми ножницами иссекался участок легочной ткани размерами 3,0x2,5X2,0 см. Кровоточащие сосуды лигировались. В образовавшийся дефект легочной ткани помещали трансплантат соответствующих размеров. В качестве ксенотрансплантата применялась подкожно-жировая клетчатка человека, приготовленная в лаборатории консервации тканей по ТУ42-2-537-2006. Перед операцией из ксенотрансплантата вырезались кусочки округлой формы соответственно размерам дефекта и помещались в физиологический раствор с антибиотиками (стрептомицин, канамицин) на 5 минут. Висцеральная плевра с подлежащей легочной тканью ушивалась непрерывно капроновыми швами. Воздух из плевральной полости удалялся пункцией через иглу электроотсосом.
Особенности техники операции при имплантации аллотрансплантатов в легочную каверну. Под интубационным наркозом с искусственной вентиляцией легких производили торакотомию через пятое межреберье справа. В рану выводилась правая диафрагмальная доля с каверной, проводилась кавернотомия. Легкое раздувалось так, чтобы каверна находилась в максимально растянутом состоянии и плотно заполнялась аллотрансплантатом соответствующего размера. Это делается для обеспечения достаточно плотного прилегания аллотрансплантата к стенкам каверны. В качестве аллотрансплантата применялась подкожно-жировая клетчатка опорной подушечки лап собак, приготовленная по методике, сходной с ТУ42-2-537-2006, но в нашей модификации (рационализаторское предложение № 26 от 27.01.89). Стенка каверны ушивалась непрерывно капроновыми швами. Других особенностей в технике операции не отмечено.
б) воспроизведение модели деструктивного туберкулеза легких у собак по И. М. Бондареву (1963).
Модель деструктивного туберкулеза легких у собак вызывалась путем внутрилегочного заражения микробной взвесью штамма Н37Rw. Колонии микробактерий туберкулеза штамма Н37Rw выращивались на картофельной среде Павловского. Премедикация собакам перед заражением не проводилась. Необходимая доза микробной взвеси вводилась трансторакально в VIII межреберье в правую диафрагмальную долю легкого. Глубина прокола грудной клетки зависела от размеров и массы животного, чтобы обеспечить попадание микробной взвеси в медиальную часть плаща легкого. Доза микробной взвеси составляла 30 мг микобактерий туберкулеза штамма Н37Rw, а в качестве депонирующего материала использовали 20% раствор желатина в количестве 1 мл. Через 4—5 недель после инфицирования рентгенологически определялась каверна в виде кольцевидной тени. Толщина стенки каверны составляла от 0,2 до 0,4 см.
2. Рентгенологические методы (рентгеноскопия, обзорная рентгенография, томография).
Контроль за качеством и скоростью течения репаративных процессов в легком после хирургического вмешательства осуществлялся рентгенологическими исследованиями в сроки от двух дней до полного заживления туберкулезной легочной каверны. Кроме этого, рентгенологические исследования проводились через 4—5 недель после инфицирования животных, и перед операцией в преимущественно в правой боковой проекции.
Подопытных животных выводили из опыта электротоком под тиопенталовым наркозом в различные сроки. После имплантации аллотрансплантатов в интактное легкое эвтаназия животных проводилась через 30, 90 и 180 суток. После биопластики аллотрансплантатом экспериментальной туберкулезной легочной каверны эвтаназия животных проводилась через 3, 12, 30 и 90 суток.
III. Патоморфологические методы (аутопсия, патогистологические исследования с окраской препаратов гематоксилин-эозином, по Ван-Гизону, импрегнацией азотнокислым серебром по В. В. Куприянову).
Для гистологических исследований препараты фиксировались в 10% растворе нейтрального формалина, обезвоживались в спиртах восходящей концентрации и заливались в парафин. Срезы, толщиной 7—10 мкм, приготавливались на санном микротоме типа Рейхерта. С каждого блока было приготовлено 6—8 гистологических препаратов. Вышеописанным способом были приготовлены и изучены 426 гистологических препаратов. Кроме гистологических методов, была применена методика морфометрии с использованием сетки Г. А. Автандилова для определения соотношения площади, занимаемой межуточной тканью и клеточными элементами, и для количественной оценки клеточного состава в трансплантате.
IV. Метод электронной микроскопии. Электронная микроскопия проводилась у животных четырех групп (6—9).
Статистическую обработку цифровых данных проводили на ЭВМ-КР-08 по стандартной программе.
Результаты собственных исследований и их обсуждение
На первом этапе исследования, с целью проверки возможности приживления, ксенотрансплантаты были имплантированы в интактное легкое.
Животные первой группы (7 собак) благополучно перенесли оперативное вмешательство по имплантации ксенотрансплантатов и последующий послеоперационный период. Однако через 2,5 недели состояние их стало ухудшаться и в сроки от 19 до 23 дней оперированные животные погибли. При аутопсии обнаружены единичные рыхлые сращения в области послеоперационного рубца. Экстравазата в плевральной полости нет. В толще легочной паренхимы, на месте имплантируемого ксенотрансплантата, пальпируется округлое образование тугоэластической консистенции размером 0,6х0,7 см. Отмечались резко увеличенные регионарные лимфатические узлы. Со стороны паренхиматозных органов отмечались следующие изменения. Почки увеличены в размерах, дряблые, корковый слой на разрезе бледно-серый, тусклый. Печень набухшая, дряблая, тестоватой консистенции, бледная. Селезенка дрябловатой консистенции, на разрезе ткань выбухает за пределы соединительной капсулы и имеет тусклый оттенок. При гистологическом исследовании — ксенотрансплантаты инфильтрированы преимущественно нейтрофилами и лимфоцитами на глубину от 900 до 1200 мкм. В прилежащей легочной ткани выраженная клеточная инфильтрация с наличием плазматических клеток, лимфоцитов, макрофагов и недифференцированных соединительнотканных клеток.
Непосредственной причиной гибели животных явились выраженная иммунологическая реакция на ксенотрансплантат. Об этом свидетельствовали увеличенные регионарные лимфатические узлы, которые являются характерным признаком выраженной реакции тканевой несовместимости, и преобладание лимфоцитов в периферической зоне ксенотрансплантата и прилегающей легочной ткани. Известно, что лимфоциты являются главными иммунокомпетентными клетками в реакциях тканевой несовместимости. Это подтверждается и изменениями токсико-дистрофического характера со стороны паренхиматозных органов — печени, почек, селезенки.
На II этапе исследования мы имплантировали аллотрансплантаты в интактное легкое не только с целью проверки возможности приживления, но и для изучения динамики структурных изменений аллотрансплантата. Для этих целей были использованы животные 2-й, 3-й и 4-й групп. Животные указанных групп, благополучно перенесли оперативное вмешательство, отмечалось гладкое течение послеоперационного периода.
Исследования показали, что аллотрансплантаты, имплантированные в интактное легкое, васкуляризуются и хорошо приживаются.
Мы отметили, что уже в ранние сроки (до 30 суток), 2-я группа животных—8 собак определяется врастание кровеносных сосудов в аллотрансплантат. Состав клеток тканевого ложа во многом идентичен составу клеточного инфильтрата стромы и состоит преимущественно и недифференцированных соединительнотканных клеток. Регенерирующаяся соединительная ткань от плевры в виде тяжа достигает зоны аллотрансплантат. По ходу указанного тяжа имеется выраженная клеточная инфильтрация в виде «юных» фибробластов. Происходит замещение аллотрансплантата собственной соединительной тканью из наиболее близкого источника, в данном случае плевры. В других случаях этим источником являются перибронхии и адвентиция крупных кровеносных сосудов.
По данным морфометрии, через 30 суток после имплантации в интактное легкое клеточный состав в центральной и периферической зоне аллотрансплантата неодинаков. В периферической зоне преобладают макрофаги: 91±5 (Р<0,5)— 37,9% и фибробласты: 101 + 1 (Р<0,05) — 42,1 %; в центральной зоне соответственно—76±3 (Р<0,5)—47,6% и 42,± 3,0—(23,3%), что свидетельствует о выраженных явлениях пролиферации соединительной ткани. Наличие лимфоцитов в центральной зоне 37,5±5,0 (23,5%) и в периферической 37.0±3,0 (Р<0,5)—15,4%, а также нейтрофилов соответственно 4,0+1,0 (25%) и 11,0+2 (Р<0,05)— 4,6% объясняется неспецифической воспалительной реакцией на аллотрансплантат.
В более поздние сроки (90 суток), 3-я группа животных — 6 собак при гистологическом исследовании определяется регенерат, имеющий выраженную фуксинофильную периферическую зону. В центре аллотрансплантата выявляются ярко-красные новообразованные волокна, формирующие рыхлую сеть. При морфометрии в эти же сроки констатируется, что количество лимфоцитов уменьшается, особенно значительно в периферической зоне 1,0±0,5 (Р<0,05)—0,4% по сравнению с центральной зоной аллотрансплантата 24,0±4,5—14,0%. В центральной зоне отсутствуют нейтрофилы, в периферической они представлены единичными клетками —2,0+0;5-(0,9%).
Увеличилось количество макрофагов в центральной зоне до 97,0+0,9 (Р<0,05)—57% и фибробластов до 49,0±2,0 (Р<0,05)—28,8%.
В периферической зоне они представлены соответственно 65,0+4,0 (Р<0,05)—31,2% и 140,0+4,0 (Р<0,05)—67,3%. Преобладание макрофагов и фибробластов в обеих зонах аллотрансплантата связано с образованием фибриллярных структур соединительной ткани. Уменьшение лимфоцитов в обеих зонах и отсутствие нейтрофилов в центральной зоне свидетельствовало о стихании воспалительной реакции на имплантированный аллотрансплантат.
Полученные результаты позволили нам перейти к III этапу исследования — биопластике аллотрансплантатом экспериментальной легочной каверны. На этом этапе исследования было использовано четыре группы животных по 5—6 собак в каждой. После воспроизведения деструктивного туберкулеза легких животные этих групп не получали антибактериальную терапию в течение 2-2,5 месяцев. За этот срок стенки каверны очищались от казеоза. Перед операцией проводилась обзорная рентгенография органов грудной клетки. На рентгенограммах легочная каверна представлена в виде кольцевидной тени.
Исследования показали, что аллотрансплантаты имплантированные в легочную каверну васкуляризируются и хорошо без осложнений и побочных эффектов приживаются. Строение аллотрансплантата в ранние сроки (3-12 суток) не претерпевает значительных изменений и характеризуется выраженной полиморфноклеточной проферацией в периферической зоне трансплантата, которая распространяется на прилежащую легочную ткань. На 3-й день после биопластики аллотрансплантатом туберкулезной легочной каверны в периферической зоне наблюдается преобладание нейтрофилов 47.0+5.3—61% от общего числа клеток, макрофагов 14,0+5,1 (Р<0,05)—2,0%, фибробластов 4,0+1,1—.(5%), лимфоцитов 12,0.+3,4 (Р<0,05) —16%. Центральная часть аллотрансплантата свободна от клеток.
Следовательно, в первые дни после имплантации отмечается умеренная воспалительная реакция с преобладанием в клеточном инфильтрате нейтрофилов. При электронной микроскопии тканевого ложа отмечается активный транэндотелиальный транспорт микровезикул.
На 12-е и 30-е сутки в периферической зоне количество нейтрофилов уменьшилось с 43,0+5,6 (Р<0,05)— 29% до 5,0±2,1 (Р<0,05)—2%. В центре аллотрансплантата их количество на 12-е сутки увеличилось до 115,0+10,2 (Р<0,05) — 69%, а к 30 суткам резко уменьшилось до 4,0+1,5 (Р<0,05) — 2%. Количество макрофагов и фибробластов увеличилось к этому сроку (12 дней), как в периферической, так и в центральной зонах. На 12-е сутки в периферической зоне аллотрансплантата макрофагов было 69,0+6,9 (Р<0,05)— 46%, а в центральной зоне—23,0+5,1 (Р<0,05) — 15%, фибробластов 15,0+6.1 (Р<0,05) —10% и 2,0+0,8 (Р<0,05) —1% соответственно.
При электронной микроскопии на 12-е сутки изучение структуры гигантских клеток в трансплантате показало, что это типичные секретирующие и фагоцитирующие макрофаги. Они характеризуются гранулярной эндоплазматичсской сетью, огромными фаголизосомами, многочисленным цитоплазм этическими выростами.
На 30-е сутки макрофагов в периферической зоне и в центре аллотрансплантата 92,0+8,6 (Р<0,05)— 38% и 80,0+ 10,3 (Р<0,05)—50% соответственно. Количество фибробластов значительно увеличилось как в периферической зоне, так и в центре трансплантата—107,0+7,9 (Р<0,05)- 44% и 39,0+5,5 (Р<0,05)—24%.
При электронной микроскопии на 30-е сутки обнаружились участки новообразованных коллагеновых волокон и фибробласты, для которых характерны вакуоли с коллагеновыми фибриллами, редукцией гранулярного эндоплазматического комплекса.
К 90 сушам наблюдалось значительное увеличение макрофагов в центральной зоне трансплантата 106,0+12,6—61%. Количество фибробластов в периферической зоне было больше 140,0+13,6 (Р<0,05)—64%, чем в центральной зоне аллотрансплантата 47,0±5,7—27%.
При электронной микроскопии определялись пучки коллагеновых волокон регенерата, сформировавшегося на месте трансплантата на 90-е сутки после биопластики каверны.
Характер клеточного инфильтрата позволил предположить, что основными клетками, принимающими участие в морфологических преобразованиях трансплантата, являются макрофаги и фибробласты. Известно, что основной функцией фибробластов является образование фибриллярных структур соединительной ткани.
В периферической и центральной зоне аллотрансплантата во все сроки наблюдения отмечалось умеренное количество лимфоцитов (12—16%), присутствие которых мы связываем со специфическим процессом в легких собаки. Однако через 90 суток после биопластики аллотрансплантатом легочной каверны в периферической зоне трансплантата лимфоцитов мы не обнаружили. Отсутствие специфических изменений в стенке каверны мы объяснили присутствием макрофагов, так как известно, что микобактерии разрушаются внутриклеточно и преимущественно в макрофагах. В то же время нельзя исключить действие тканевой терапии после биопластики аллотрансплантатом. Так как тканевая терапия стимулирует процессы рассасывания и регенерации. Возможно, что биопластика аллотрансплантатом не только устраняет наличие каверны в легком, но и оказывается на нее лечебное воздействие.
В более поздние сроки происходит замещение трансплантата соединительной тканью (регенератом), полностью прочете замещения заканчивается в среднем через 90 суток после биопластики.
Анализ полученных результатов позволил нам представить происходящие процессы следующим образом. Приживление аллотрансплантатов из подкожно-жировой клетчатки опорных подушечек лап собак, приготовленных по нашему лабораторному регламенту, происходит по аллостатическому типу (замещение аллотрансплантата собственной соединительной тканью). Имплантированный биологический материал соединительнотканной природы создаст источник коллагена, который, подвергаясь деструкции, выступает в качестве стимулятора регенерации соединительной ткани. После созревания соединительной ткани новообразованные коллагеновые волокна, контактирующие с фибробластами, оказывают ингибиругощее влияние на биосинтез коллагена с одновременной индукцией фиброклазии, что согласуется с теорией ауторегуляции соединительной ткани по В. В. Шехтеру (1981). Эти процессы завершаются относительной стабилизацией сформированной соединительной ткани.
Сформировавшийся на месте аллотрансплантата регенерат по своим свойствам и параметрам мало отличается от самого трансплантата, вследствие чего пластическая операция по закрытию легочной каверны аллотрансплантатом может быть вполне эффективной.
Результаты экспериментальных исследований и разрешение Министерства здравоохранения СССР от 22 июля 1987 года № 87/901-87 на применение в медицинской практике аллотрансплантатов, приготовленных по техническим условиям № 42-2-537-2006, и разрешение ЦНИИТ Российской Академии медицинских наук № 89-215 от 28 февраля 1992 г. на ограниченное клиническое применение разработанного метода позволили нам провести его клиническую апробацию.
Далее, при изложении результатов клинической апробации, данный аллотрансплантат будет называться Аллоплантом. Под наблюдением находилось трое больных с фиброзно-кавернозным туберкулезом легких, которым была проведена биопластика каверны Аллоплантом. При подготовке больных к операции их тщательно обследовали, проводили общеукреплящее лечение, так как общее состояние организма оказывает большое влияние на исходы пластических операций.
При операции возможны 2 варианта исполнения. При первом варианте проводится только биопластика легочной каверны. При втором — биопластика комбинировалась с торакопластикой. Мы применили 2-й вариант.
Сначала провели 5-ри реберную торакопластику по обычной методике. При вскрытии каверны устья мелких бронхов прижгли каутером, а крупные дренирующие бронхи ушивали капроновыми швами. Стенку каверны тщательно обрабатывали трихлоруксусной кислотой, при выскабливании стенок каверны ложечкой Фолькмана добивались капиллярного кровотечения, так как большая роль в трансформации Аллопланта принадлежит кровеносным сосудам, которые с первых дней биопластики начинают врастать в трансплантат. Затем легочную каверну плотно заполнили Аллоплантом, ее стенки ушивали по обычной методике.
Ведение послеоперационного периода не отличалось от такового при обычных операциях на органах грудной полости, в частности, торакопластики. Наблюдения показали, что во всех случаях каверны закрылись.
В заключение нам кажется целесообразным выделить некоторые преимущества биопластики Аллоплантом туберкулезной легочной каверны. Разработанный способ лечения позволяет расширить методы местного лечения каверны. Предлагаемый материал пластичен, дает возможность легко выкраивать трансплантаты необходимой формы и размера. Трансплантат не требует фиксации швами, а применение аллогенного материала исключает дополнительную операцию по взятию аутотрансилантата. Аллоплант оказывает лечебное воздействие на каверну, вследствие эффективности тканевой терапии.
Таким образом, разработанный способ лечения туберкулезной легочной каверны с применением консервированного биологического аллогенного материала соединительнотканной природы, и полученные результаты клинической апробации создают предпосылки к внедрению этого метода во фтизио-хирургическую практику.
Заключение
Разработана новая техника операции — биопластика аллотрансплантатом туберкулезной легочной каверны в эксперименте. Аллогенные материалы Аллоплант для замещения объемных дефектов тканей при имплантации в легкое с дефектом ткани способствуют формированию соединительнотканного регенерата с восстановлением адекватного микроциркуляторного русла.
Аллогенные материалы Аллоплант при биопластике экспериментальной легочной каверны замещаются соединительнотканным регенератом с ликвидацией специфических изменений стенки каверны в виде «звездчатого» рубца.
Ксеногенные материалы соединительнотканной природы, имплантированные в легкое, вызывают выраженную реакцию отторжения, сопровождающуюся увеличением регионарных лимфатических узлов, преобладанием лимфоцитов в периферической зоне ксенотрансплантата и окружающей легочной ткани.
Биопластика Аллоплантом расширяет методы местного лечения туберкулезной легочной каверны и может явиться операцией выбора у тех больных деструктивным туберкулезом, которым традиционные методы хирургического лечения были не показанными.
Практические рекомендации
Метод биопластики Аллоплантом рекомендуется для закрытия туберкулезных легочных каверн у больных деструктивным туберкулезом. При наличии казеоза в легочной каверне oт предполагаемой биопластики следует воздержаться. Крупные дренирующие бронхи легочной каверны обязательно следует ушить капроновыми швами, мелкие устья бронхов прижигать каутером. Стенка легочной каверны после биопластики ушивается наглухо. Биопластика Аллоплантом может быть применена в качестве самостоятельного вмешательства или одновременно с торакопластикой.
Литература
1. Могут ли ткани и кровеносное русло неопорных участков кожи адаптироваться к действию опорных нагрузок? //Микроциркуляторное русло соединительнотканных образований. Сборник научных трудов, г. Уфа, 1988 г. с. 37—42 (Инченко К.С. с соавт.).
2. Биопластика туберкулезных каверн легкого в эксперименте. //Проблемы туберкулеза. — 1991. — № 8. — с. 72—74 (Инченко К.С. с соавт.).
к содержанию | опубликовать статью
АУТОПЛАСТИЧЕСКОЕ УСТРАНЕНИЕ ТРИХИАЗА МИКРОХИРУРГИЧЕСКОЙ РОТАЦИЕЙ
РЕСНИЧНО-ТКАНЕВОГО КОМПЛЕКСА (анатомо-экспериментальное и клиническое исследование)
Уваров А. М.
Работа выполнена в Оренбургском филиале ФГУ «Межотраслевой научно-технический комплекс «Микрохирургия глаза» им. акад. С.Н.Фёдорова, Росмедтехнологии» и на кафедре клинической анатомии и оперативной хирургии им. С.С. Михайлова ГОУ ВПО «Оренбургская государственная медицинская академия» Федерального агентства по здравоохранению и социальному развитию РФ
Автор предлагает рабочую классификацию трихиаза и классификацию способов лечения. В статье описаны три вида микрохирургического способа ротации реснично-тканевого комплекса в исполнении, которые обеспечивают стойкий лечебно-косметический эффект, в связи с чем могут быть рекомендованы для внедрения в клиническую практику офтальмологов. Приводится описание трепана для выкраивания реснично-тканевого комплекса.
Актуальность
Трихиаз – неправильный рост ресниц в сторону глазного яблока с травмированием роговицы и конъюнктивы, последующими органическими изменениями в них, болевыми ощущениями, снижением зрения.
Исследование трихиаза являлось частью изучения трахомы, а методы его устранения входили в комплексное лечение трахоматозного поражения век. Для исправления рубцовых деформаций краёв век и конъюнктивы требовались обширные вмешательства, которые были достаточно травматичными (В.Н.Архангельский (ред.), 1962; Н.А. Пучковская (ред.), 1981; Т.И. Ерошевский, А.А. Бочкарева (ред.), 1983; Е.И.Ковалевский, 1986; A.F.Mac Calian, 1936; J.S.Friedenwald, 1952; P. Verin, 1980;). Ликвидация трахомы в России привела к превалированию в этиологии трихиаза воспалительных заболеваний, травмы, ожогов век, врождённого трихиаза – дистихиаза, трихиаза следствие радиоактивного облучения. Трихиаз, став локальным не исчез, а функциональные и косметические требования к его лечению возросли. Пациентов не устраивают традиционные методы в виде эпиляции, резекции, термо- и диатермокоагуляции неправильно растущих ресниц. Исходом таких вмешательств является либо рецидив заболевания (Н.И. Андорский, 1931; А. Фессиус, 1903;), либо алопеция края век, что является серьёзным косметическим дефектом. Офтальмохирурги совершенствуют методы лечения трихиаза. В Оренбургском филиале ФГУ МНТК «Микрохирургия глаза» разработана технология устранения трихиаза методом аутопластического расширения интермаргинального пространства посредством ротации ромбовидных сегментов хряща (В.Н. Канюков, 1991). Другие новые варианты лечения трихиаза или энтропиума (Э.В. Егорова,2005; T.H.Wojono,1992; J.Moore, 2009.) по сути дела модифицируют, либо миниатюризируют известные способы. Данные методики ориентированы на обширный трихиаз. Локальный, как и обширный трихиаз до сих пор, подвергается традиционным методам лечения к которым добавилась лишь лазеркоагуляция. Микрохирургическая техника позволяет сохранять ресницы, но они продолжают уничтожаться. В этом заключается противоречие, устранение которого должно было привести к развитию нового направления в лечении локального трихиаза. Определённым препятствием для внедрения микрохирургической техники в практику лечения локального трихиаза является отсутствие сведений по микроанатомии и микротопографии ресниц (Краснов М.Л.. 1952; Вит В.В., 2003). Всё это послужило основанием для научного исследований проблемы локального трихиаза.
Целью исследования явилось повышение эффективности микрохирургического лечения локального трихиаза на основе метода аутопластической ротации реснично-тканевого комплекса.
Материал и методы исследования
Работа выполнена в Оренбургском филиале ФГУ МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова», Росздрава и кафедре оперативной хирургии и клинической анатомии им. С.С. Михайлова ОрГМА.
Экспериментальные исследования проведены на поросятах в ветеринарной клинике г. Нижневартовска и сегментах век трупов людей в Бюро судмедэкспертизы ХМАО - Югра. Клиническая апробация метода проведена в Муниципальном Учреждении «Городская поликлиника» г. Нижневартовска.
Анализ эпидемиологии трихиаза выполнен на основе статистических отчёты медицинских учреждений г.Нижневартовска. Отчёты включают сведения по дополнительной диспансеризации населения (ДДН), данные углубленного осмотра (УМО) и профилактического осмотра (ПО), выполненные в рамках приоритетного национального проекта «Здоровье». Они подтвердили актуальность проблемы, став основой программы по изучению трихиаза и методов его лечения.
Сравнительный анализ строения реснично-тканевого комплекса человека и поросят выполнен по гистотопографическим препаратам. Исследования микроанатомии и микротопографии строения ресниц человека выполнялось по секционному материалу сегментов восьми век двух трупов людей. Изъяты сегменты век 4х5х3мм., а дефекты закрыты швами. Сегменты век трупа помещались во флаконы с 1% -м раствором формалина с обозначением сег/тр/верх. и сег/тр./ниж. Для исследований создана полезная модель «Фиксатор сегментов мягких тканей». (Положительное решение ФИПС на выдачу патента РФ на полезную модель № 2009127659/22 (038465) от 20.07.2009г).
Группа экспериментальных животных (поросят) состояла из семи особей двухмесячного возраста, с весом от 10.7кг до 17.4кг, отобранных из стада в 122 головы. Выбор поросят обусловлен макроскопическим сходством строения век и ресниц с таковыми у человека. Критерии выбора особей: клинически здоровые; эпидокружение; с прививками, без аллергических реакций; не агрессивные. Условия эксперимента: оперировать всех в одном возрасте, в одно время, в одних условиях. Животные содержались в отдельном вольере для контроля за их здоровьем, уходом за оперированными веками, облегчением их отлова. Все они остались живы, набирали вес лучше своих собратьев из основного стада.
Исследования микроанатомии и микротопографии строения ресниц экспериментальных животных выполнялось по гистотопографическим препаратам, изготовленных из сегментов четырёх век одного поросёнкаЭкспериментальные вмешательств на реснично-тканевом комплексе выполнялись на веках шести поросят.
Три поросёнка составили контрольную группу. Им выполнялись традиционные виды вмешательств: первому – эпиляция, второму – термокоагуляция, третьему – диатермокоагуляция ресниц.
Три поросёнка составили основную группу, в которой выполнены все три разработанных вида ротации реснично-тканевого комплекса: Первому животному реснично-тканевой комплекс ротирован ланцетовидным выкраиванием, второму – треугольным выкраиванием, третьему – выкраивание трепаном.
Для изучения микроанатомии, микротопграфии, анализа морфологических изменений в зонах вмешательств у каждого животного изъяты сегменты кожи век с оперированным ресничным краем, 4х5х3мм. Сегменты в/века левого глаза изъяты через 2 часа после операции, сегменты н/века левого глаза – на седьмые сутки; сегменты в/века правого глаза – на 14-ые сутки. Сегменты век животных помещались во флаконы с 1% -м раствором формалина под № Х/Х (№животного/ №препарата).
Методы экспериментальных вмешательств
Техника разработанных вмешательств на реснично-тканевом комплексе. Ланцетовидное выкраивание и ротация реснично-тканевого комплекса (Положительное решение ФИПС на выдачу патента РФ на изобретение № 209137610/20 (053159) от 12. 10.2009г.) Лезвие в держателе выстоит 5 мм. Экспериментальная ресница выделяется двумя встречными полулунными разрезами (A), на глубину волосяного фолликула. От наружного угла разрез продляется кпереди длиной и глубиной 5 мм (B). Реснично-тканевой комплекс глубиной 5 мм захватывается пинцетом, смещается, опускается в новое ложе(C), в фиксируется одним швом 10/0, позади ресницы (D). (рис. 1).

Рис. 1. Ланцетовидное выкраивание и ротация реснично-тканевого комплекса
Треугольное выкраивание и ротация реснично-тканевого комплекса. (Положительное решение ФИПС на выдачу патента РФ на изобретение № 209137610/20 (053159) от 1 2. 20.2009г) Лезвие в держателе выстоит 5 мм. Позади ресницы для эксперимента разрез параллельно краю века. От его краев, кпереди под углом 60°, выполняются два разреза, встречающиеся перед ресницей.(А). Реснично-тканевой комплекс ротируется (В) и фиксируется в новом положении (С) одним -двумя швами 10/0 (рис. 2)
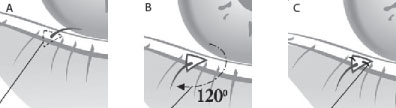
Рис. 2. Треугольное выкраивание и ротация реснично-тканевого комплекса
Выкраивание и ротация реснично-тканевого комплекса трепаном собственной конструкции(1 мм, 2 мм, 3мм). (Положительное решение ФИПС на выдачу патента РФ на изобретение № 209137609/20 (053158) от 1 2. 10.2009г.) Трепан одевается на ресницу(А). Вращательными движениями выкраивается реснично-тканевой комплекс глубиной 5 мм. (В) Реснично-тканевой комплекс ротируется на заданный (от 10° до 180°) угол вокруг оси (С) и фиксируется в новом положении двумя швами 10/0.(D) (Рис. 3).
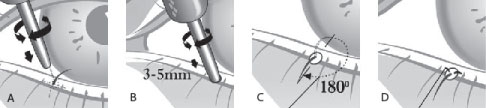
Рис. 3. Трепаном выкраивание и ротация реснично-тканевого комплекса
Инструменты и оборудование для выполнения эксперимента
Экспериментальные операции выполнялись в ветеринарной клинике, оснащённой ветеринарным операционным столом. Как операционный микроскоп использована широкоугольная лупа с 4-мя сменными линзами и подсветкой, объединения «Беркут». Операции выполнялись под офтальмологическим операционным микроскопом «ЛОМО» выпуска 1978г. Выполнение операций производились микрохирургическими инструментами Казанского завода «Микрон». Диатермокоагуляция волосяных луковиц ресниц осуществлялась аппартом «ФОТЕК». Фоторегистрацию состояния век осуществляли с помощью цифрового фотоаппарата с трансформацией на компьютер. Эффект лечения определялся методом вариационной статистики с использованием персонального компьютера на базе процессора Pentium IV с использованием программного обеспечения Microsoft Exell XP.
Методы изъятия и изготовление микропрепаратов
Эксперименты выполнялись бригадой, состоявшей из врача- хирурга (Уваров А. М.), ветеринарного врача - анестезиолога, операционной сестры.
Хирургический набор состоял из шприца 2.0, трёх марлевых салфеток, пяти шариков, окончатого зажима-пинцета, пинцета для завязывания; лезвиедержателя, лезвия; ножниц остроконечных и изогнутых; иглодержателя, шов 10/0 с впаянной иглой. Дополнительные инструменты: для эпиляции - пинцет для эпиляции; для термокоагуляции - игла – термокаутер; для диатермокоагуляции - аппарат «Фотек» с иглой – электродом. Инструменты стерилизовались в автоклаве поликлиники, с маркировкой «В» - ветеринарные.
Наркоз свиней в литературе не описан. Нами применено общее обезболивание поросят препаратом ВЕТБУТАЛ, внутрибрюшинно в дозе - 0.22мг/кг (ср. доза 0.13 – 0.25мг/1кг веса) с дополнением местной анестезии раствором лидокаина 2% - 2.0 в веко. Указанное обезболивание применено каждому животному, во всех случаях вмешательства на веках, включая операции по изъятию сегментов век.
Дефекты тканей век, образовавшиеся после изъятия сегментов в ходе эксперимента, закрыты двумя встречными П-образными кожными лоскутами, выкроенными послабляющими разрезами на всём протяжении века с наложением узловатых швов на края раны.
Ход каждого вмешательства зафиксирован фото и описан.
Обработка секционного материала от животных и трупного материала выполнялась по стандартной методике гистотопографическим методом с окраской срезов гематоксилином-эозином и по ван-Гизон. Гистотопографические препараты готовились в 4 этапа.
1-й.Забор и фиксация фрагментов век. 2-й.Обезвоживание и заливка в целлоидин. 3-й. Приготовление срезов на санном микротоме. 4-й.Окраска срезов гематоксилином-эозином по обычной методике.
Окраска по ван-Гизон пикрофуксином. 1. Перекрашивание срезов в свежеприготовленном гематоксилине Вейгерта 3-5 минут; 2. Прополаскивание в двух порциях воды; 3. Окрашивание пикрофуксином 2-3 минуты; 4. Споласкивание в воде 5-15 секунд; 5. Проводка через 96° спирт 1-2 минуты; 6. Просветление в карбол-ксилоле, ксилоле, заключение в бальзам, покровное стекло. Изучение гистотопографических препаратов выполнялось под микроскопом с увеличением х8, х 32.
Методы клинических исследований
Обследование и подготовка. Пациенты обследовались по общепринятой офтальмологической методике, включающей сбор анамнеза, определение симтомокоплекса патологии век, определение остроты зрения (до и после оперативного вмешательства), биомикроскопию, офтальмоскопию, тонометрию. Определение остроты зрения проводили по таблицам Головина - Сивцева. Пациенты с хроническим блефаритом обследовались на демодекс. Общее обследование осуществлялось участковым терапевтом с выполнением клинического минимума, включающего флюрографию, кровь на RW, ОАК, анализы мочи, кала. По показаниям исследовалась биохимия крови, снималась ЭКГ, пациенты консультировались эндокринологом, кардиологом. Обследование завершалось заключением терапевта с рекомендациями лечения сопутствующих заболеваний. Пациенты в день операции госпитализировались в Дневной стационар при поликлинике, где пребывали в течение двух – трёх дней. На каждого из них заполнялась История болезни.
Подготовка к операции включала осмотр пациента в офтальмологическом кабинете врачом – хирургом, внесение в операционный список, юридическое обоснование в виде оформления листа согласия на операцию, заполнение Истории болезни. В оперируемый глаз инстилляции растворов левомицетина 0.25%, сульфацила натрия 30%. После подготовки пациенты провожались к кабинету амбулаторной хирургии глаза (КАХГ), расположенному в хирургическом блоке поликлиники.
На операционном столе: Анестезия глазного яблока Sol.Dicaini 0,5%, веки обрабатывались 70% раствором этилового спирта, после чего анестезия дополнялась Sol. Lidocaini 2% - 2.0 в толщу века. После достижения обезболивания выполнялось оперативное вмешательство по запланированной методике. Операция завершалась инстилляцией растворов левомицетина 0,25%, рибофлавина 0,02%, закладывалась прогретая тетрациклиновая 1% мазь, накладывалась монокулярная повязка на сутки. Пациент находился до 17 часов в Дневном стационаре, получая лечение по совместным, с терапевтом, назначениям. Начиная со дня операции, ежедневно, пациенты получали УВЧ – терапию на оперированный глаз, № 5, в нетепловой дозе. Перевязки оперированного глаза выполнялись ежедневно в Дневном стационаре. Пациенты после выписки закапывали растворы и закладывали мазь самостоятельно до пятого дня. Швы снимались на шестой день со дня операции.
Статистическая обработка исходных данных выполнена по РТК с последующим построением гистограмм, характеризующих частоту попадания выборочных значений в определенный интервал. Частотное распределение полученных наблюдений по выбранным диапазонам, средние значения (M), максимальные и минимальные значения выборок и стандартное отклонение σ, оценивалось последующим сравнением выборочных данных с помощью непараметрического U-критерия Уилкоксона.
Результаты собственных исследований
Анализ эпидемиологии трихиаза.
Диспансеризация населения, в рамках национального проекта «Здоровье», выявляет, в том числе, пациентов с трихиазом в Ханты - Мансийском Автономном Округе - Югра. Наличие больных определило потребность разработки нового направления в хирургическом лечении трихиаза (табл. 1).
Вид осмотра |
Годы | ||||
|---|---|---|---|---|---|
| 2006 | 2007 | 2008 | 2009 | 2010 | |
| ДДН (п-ки 1.2.3) | 6250 | 10391 | 11312 | 11394 | 39347 |
| Осмотр углубленный | 615 | 870 | 1082 | 636 | 3203 |
| Профилактический осмотр | 523 | 1168 | 1356 | 195 | 3242 |
| Итого | 7388 | 12429 | 13750 | 12225 | 45792 |
| выявлено пациентов с трихиазом | 5 | 9 | 9 | 8 | 31 |
| пациентов на 100 000 населения | 54.2 | 72,4 | 65.5 | 65.4 | 67.7 |
Выявление больных на 100 000 населения равномерно по годам и пропорционально количеству осмотренных. Это свидетельствует об объективности исследования, качественном выявлении заболеваний, эффективности проекта «Здоровье».
Заболеваемость трихиазом по годам определялась в пределах от 54,1 до 72, 4 пациентов на 100 000 населения, в среднем 67,7 +-.
Полученные результаты эпидемического анализа свидетельствовали о необходимости рассмотрения данной проблемы, учитывая достижения современной микрохиругической техники проведения операций.
Анатомо-морфологическое исследование ресниц с волосяными фолликулами человека и поросят
Изучение микроанатомии и микротопографии ресниц поросят показало, что внутривековая часть ресницы поросят разделена на поверхностную, окруженную кожным эпителием, и глубокую, в волосяном фолликуле. Вокруг ресницы, окружая верхнюю часть волосяного фолликула, открываются выводные протоки сальных желез. Потовые железы располагаются между фолликулами и глубже их. Морфометрическая характеристика поросят: Диаметр ресницы 50 – 100 мкм, диаметр волосяного фолликула 150 – 250 мкм, диаметр на уровне сальных желез - 400 – 600 мкм. Длина внутривековой части ресницы вместе с волосяным фолликулом равна 2 – 3 мм, длина волосяного фолликула 1,2-1,5 мм. Расстояние между ресницами составляет от 200 до 600 мкм при среднем значении 406±106 мкм в верхнем и 418±107 мкм в нижнем веке.
Изучение микроанатомии и микротопографии ресниц человека показало их почти полную идентичность с ресницами поросят. Диаметр ресниц человека в среднем =50 мкм, волосяного фолликула = 150-200 мкм., глубина внутривековой части ресницы = 2-3,5 мм, а расстояние между фолликулами - от 200 до 600 мкм при среднем значении 394±117 мкм на верхнем, и 402±108 мкм нижнем веках. В верхнем и нижнем веках человека на площади поперечного среза века в 1 мм2 находится от 3 до 5 фолликулов, так же, как и у поросят.
Ресницы поросят и человека сравнивались по совокупности данных микроанатомических и микротопографических компонентов: толщины самой ресницы, глубины залегания, фолликула, его сосудистого пучка, окружающих её сальных и потовых желёз. Всё это вместе мы обозначили, как реснично-тканевой комплекс (РТК).
Сравнение количественных показателей РТК поросят и человека свидетельствовало, что различия касаются толщины ресниц, сальных и потовых желез у поросят. Основные показатели РТК (глубина расположения фолликулов, расстояния между фолликулами, густота их расположения) в веках поросят и человека совпадают.
Результаты экспериментальных исследований по хирургическому лечению трихиаза
Выполнение и изучение традиционных методов:
Эпиляция ресниц. Микропинцетом эпилированы 18 ресниц (по 6 на каждом из 3-х век). 3-и ресницы удалено с волосяным фолликулом, а у 15-и фолликул остался в ткани века.
Через 2 часа после операции в зоне вмешательства наблюдались умеренно выраженные воспалительные явления, небольшой отек мягких тканей. В конъюнктивальной полости слизистое отделяемое. На микропрепаратах – отёк, кровоизлияние в ткани и полость, на место волосяного фолликула.
На 7сутки отек мягких тканей купировался. На микропрепаратах вокруг удаленной ресницы с волосяным фолликулом интенсивное развитие соединительной ткани, в сохранённом фолликуле рост новой ресницы.
На 14-ый день место эпиляции определялось с трудом по зоне облысения края века. На микропрепаратах соединительная ткань полностью замещала место удаленной ресницы с волосяным фолликулом. В сохранённом волосяном фолликуле продолжался рост ресницы.
Эпиляция, не смотря на малую травматичность и возможность удаления одной ресницы, сохраняет высокую вероятность возобновления её роста.
Термокоагуляция ресниц с волосяными фолликулами. Иглой-термокаутером выполнены термоинъекции волосяных луковиц ресниц. При введении иглы в волосяную луковицу удаляемой ресницы коагулировался эпителий пространства века. Мягкие ткани, вместе с ресницами пружинили, нанизываясь на иглу, которая захватывала в зону воздействия от двух до пяти рядом расположенных ресниц. Всего удалилось 26 ресниц.
Через 2 часа по ресничному краю определяется участок коагулированных тканей с тёмно-коричневой корочкой струпа, вокруг которого был выраженный отек, переходящий на интрамаргинальное пространство и конъюнктиву.
На 7-е сутки отек уменьшался, корочки частично отходили, появлялись признаки рубцевания тканей.
Через 14 суток наблюдалось интенсивное замещение дефектов края век соединительной тканью с рубцеванием. Край века деформировался, подтягиваясь в сторону рубца.
Термокоагуляция сопровождалась значительной травматизацией, носила деструктивный характер с последующим грубым рубцеванием и деформацией века.
Диатермокоагуляция ресниц с волосяными фолликулами выполнена иглой - электродом аппарата «ФОТЕК» при силе тока 2-4 мА и экспозиции 1-2 секунды. При прохождении тока через ткань, она как бы «взрывалась» с дефектом на площади в 2-3 раза больше расчётной. В зону вовлекались рядом расположенные, не подлежащие удалению ресницы. При четырёх диатермокоагуляциях ресниц на каждом веке, удалено 32 ресницы, что составляет 2.7 ресницы на 1-у диатермокоагуляцию.
Через 2 часа в зонах вмешательства просматривались глубокие дефекты тканей, с чёрными, оплавленными краями и поражением волосяных луковиц нескольких ресниц одновременно. На поперечных срезах микропрепаратов отмечались дефекты ткани овальной, вогнуто-овальной формы с оплавленными краями, обширной площадью поражения.
Через 7 суток в зоне коагуляции кожа покрыта струпом чёрного цвета, плотно сращённого с тканями. На микропрепаратах отмечены микроанатомические изменения структуры сохранившихся потовых желез вблизи образовавшихся дефектов. Сами дефекты замещались соединительной тканью с началом формирования рубца.
К 14 суткам в зоне дефекта сформировался грубый рубец. Корочки отошли. Рана очистилась, на месте вмешательства обширная зона алопеции.
Диатермокоагуляция оказалась наиболее травматичным вмешательством, в исходе которого оставался грубый рубец с деформацией краёв век, облысение.
Выполнение и изучение вмешательств собственной технологии
Ротация ресниц с волосяными фолликулами.
Выполнено по шесть ротаций ресниц на каждом из трех век, каждого из трёх экспериментальных животных. Вмешательства выполнялись на каждой реснице изолировано, отмечалось минимальное кровотечение – 1 капля в ходе операции. Фиксация швами РТК в новом положении выполнена без труда. По завершению операции зоны вмешательства от окружающих тканей отличались наличием шва и тонкими линиями разреза. Других изменений не было.
Через 2 часа на месте вмешательства небольшой отёк мягких тканей, положение ротированных ресниц устойчивое, линии разрезов просматриваются с трудом.
К 7-м суткам положение ротированных ресниц не изменилось, отличить от окружающих ресниц можно по наличию швов. Швы сняты. На гистотопограммах происходит полное срастание волосяной луковицы с окружающей тканью. Между волосяной луковицей и окружающей тканью, а также в самой ткани, окружающей луковицу, имеется тканевое кровоизлияние. Между луковичной частью ресницы и самой луковицей имеется пространство полулунной формы. Волосяная луковица как бы расширена, в ней образуется пространство большее, чем сама ресница, и она прижата к одной внутренней поверхности луковицы.
В 14 суток отличия между ротированной ресницей и интактной не определяются. На гистотопограммах незначительное расширение между луковичной частью ресницы и луковицей. Кровоизлияние полностью рассосалось.
Ротация реснично-тканевого комплекса оказалась малотравматичным вмешательством. Эксперименты показали, что все три разработанных способа уверенно выполняются и обеспечивают поворот ресниц на 10-180°.
Итоги выполнение экспериментальных операций на одном и том же виде животных, с единым методическим подходом, в единые сроки наблюдения позволяет провести сравнение результатов традиционных и разработанных видов оперативных вмешательств на ресницах.
Эпиляция, не смотря на малую травматичность и возможность удаления одной ресницы, сохраняет высокую вероятность возобновления её роста
Термо- и диатермокоагуляция травматичные вмешательства, образующие значительные дефекты в ткани века, удалить которыми одну ресницу невозможно с длительным периодом заживления. На крае века образуются обширные участки алопеции и развитием рубцов. Рубцевание приводит к деформациям века и нарушениям его функции. Временами рубцы подтягивают к себе новые ресницы, формируя предпосылки к новому варианту трихиаза. Таким образом, изученные в эксперименте традиционные способы хирургического лечения трихиаза имеют существенные недостатки.
Ротации ресниц с волосяным фолликулом этих недостатков лишены. Возможность выполнения разработанных видов оперативного лечения трихиаза экспериментально показана в каждом из трех вариантов. Ротация является малотравматичным вмешательством, сохраняет ресницу, изменяя направление, и угол ее роста, не нарушает структуры ближайших ресниц, их сальных и потовых желез.
Изучение особенностей микрохирургической анатомии ресниц, статистическая обработка исходных данных с последующим сравнением выборочных данных с помощью непараметрического U-критерия Уилкоксона, позволили установить, что искомый коэффициент Р во всех случаях оказался больше 0.05, и означает, что сравнимые выборки статистически достоверно не различимы между собой. Практически это позволяет выполнять вмешательства на отдельных ресницах.
Из четырех способов операций на ресницах: эпиляции, термокоагуляции, диатермокоагуляции, ротации наиболее обоснованным анатомически и функционально является разработанный способ ротации ресницы с волосяным фолликулом.
Результаты клинических исследований
Анализ клинического материала включает этиологию, симптоматику, осложнения, сопутствующую офтальмопатологию, распределение трихиаза по векам в обеих группах пациентов. Сравниваются традиционные методы устранения трихиаза и способы ротации реснично-тканевого комплекса.
В анализ клинических исследований по лечению локального трихиаза в период с 2002 по 2009годы включены данные о 63 пациентов, состоявших из группы контроля, с вмешательствами традиционными способами и основной группы с вмешательствами, разработанными нами способами.
Обе группы сопоставимы по половому признаку, возрасту и нозологии. Контрольная группа наблюдения состояла из 32(50.8%) пациентов, 13 (46.875%) мужчин и 19 (53.125%) женщин в возрасте от 9до 74лет. (Таблица 2).
| Пол | Распределение по возрасту | Всего | |||||||
|---|---|---|---|---|---|---|---|---|---|
| до 10л | 11-19л | 20-29л | 30-39л | 40-49л | 50-59л | 60-69л | 70-74г | ||
| Мужчины | - | 1 | 3 | - | 1 | 4 | 3 | 1 | 13 |
| Женщины | 1 | 0 | 6 | 3 | 2 | 2 | 4 | 1 | 19 |
| Всего | 1 | 1 | 9 | 3 | 3 | 6 | 7 | 2 | 32 |
Основная группа наблюдения состояла из 31(49.2%) пациента, 15 (48.4%) мужчин и 16 (51.6%) женщин в возрасте от 20 до 74 лет. (Таблица 3).
| Пол | Распределение по возрасту | Всего | |||||
|---|---|---|---|---|---|---|---|
| 20-29л | 30-39л | 40-49л | 50-59л | 60-69л | 70-74г | ||
| Мужчины | 3 | 1 | 3 | 7 | 1 | - | 15 |
| Женщины | 4 | 2 | 5 | 2 | 2 | 1 | 16 |
| Всего | 7 | 3 | 8 | 9 | 3 | 1 | 31 |
Причины трихиаза (этиология) являются, едва ли не главным определяющим фактором в составлении не только системы взглядов на это заболевание, но и базой для составления прогноза на объёмы требуемой хирургической помощи в будущем (таб. 4).
| Этиология трихиаза | Количество пациентов контрольной группы | Количество пациентов основной группы |
|---|---|---|
| Хронический блефарит | 12 | 13 |
| Механическая травма | 9 | 8 |
| Химический ожог | 6 | 5 |
| Ожог пламенем | 1 | 1 |
| Рубцовая деформация после рентгеновского облучения | 1 | 1 |
| Рубцовая деформация век после кантопластики | - | 1 |
| Наследственный трихиаз | 1 | 1 |
| Спонтанный трихиаз | 1 | 1 |
| Последствия трахомы | 1 | - |
Распределение пациентов с трихиазом по этиологическому фактору
В этиологии трихиаза превалируют травмы: механические, химические ожоги и ожоги пламенем. В совокупности они превышают хронический блефарит. Единичные случаи после R-облучения, планового хирургического вмешательства, наследственный трихиаз (дистихиаз), нет осложнений трахомы – таковы причины трихиаза пациентов основной клинической группы в Ханты-Мансийском Автономном Округе – Югра. В контрольной группе, в причинах трихиаза, добавился один случай трахомы IV.
В имеющихся литературных источниках системы по проблеме трихиаза не обнаружено. На основе литературных данных, собственных исследований составлена:
Рабочая классификация трихиаза
По этиологическому фактору (причинам возникновения):
1.Механическое повреждение: А) исход резаных ран; Б) размозжения век;
2.Химический ожог А)кислотами Б)щелочами; 3. Ожог пламенем;
4. Сочетанное термо-химическое поражение; 5. Деформация век в результате радиоактивных излучений;
6. Семейно – наследственный трихиаз (дистихиаз); 7. Гнойное поражение краёв век с последующим рубцеванием; 8. Трахома; 9.Спонтанный трихиаз.
По локализации зоны расположения:
1. Центральная зона; 2. Медиальная зона; 3.Латеральная зона; 4.Трихиаз слёзного мясца.
По степени выраженности:
1. Единичные ресницы; 2.Одна зона; 3. Две зоны; 4.Все веко
По расположению на веках:
- Верхнее веко; 2.Нижнее веко; 3.Оба века
По топографии века:
1. Наружный край века. 2.Интермаргинальное пространство; 3.Внутренний край века; 4.Прорастание ресницы через конъюнктиву.
По осложнениям:
-
Дистрофия конъюнктивы: а) кистозная дистрофия; б) пингвекулит; в)птеригиум.
-
Дистрофические изменения в роговице: а)гиперплазия эпителия; б) дистрофия роговицы; в) помутнение роговицы (бельмо).
| Симптомы | Частота в основной группе | Частота в контрольной группе | ||
|---|---|---|---|---|
| абс. | % | абс. | % | |
| Слезотечение | 18 | 58.4 | 17 | 53,3 |
| Рези | 16 | 51,6 | 17 | 53,3 |
| Снижение зрения | 14 | 45,2 | 15 | 46,8 |
| Ощущение инородного тела | 13 | 41,9 | 9 | 28,1 |
| Светобоязнь | 11 | 35,4 | 12 | 37,5 |
| Блефароспазм | 11 | 35,4 | 8 | 25,0 |
| Затуманивание зрения | 5 | 16,1 | 8 | 25,0 |
| Сухость | 3 | 9,6 | 6 | 18,8 |
Основным симптомокомплексом трихиаза являлась совокупность следующих жалоб: слезотечение, снижение зрения, ощущение инородного тела, светобоязнь и блефароспазм, редко на затуманивание зрения и сухость в глазу.
Длительное существование контакта ресница + глазное яблоко неизбежно приводит к осложнениям, которые мы представляем в системе:
Осложнения трихиаза разделены на непосредственные и отдалённые.
I.Непосредственные осложнения:
1.Постоянные тягостные ощущения инородного тела; 2.Микроэрозии эпителия конъюнктивы и роговицы; 3.Развитие кератита;
II.Отдалённые осложнения:
-
Дистрофия конъюнктивы (кисты, пингвекулы, птеригиум).
-
Дистрофия роговицы (гиперплазия эпителия, помутнение, васкуляризация);
-
Снижение зрения.
В основной группе у 19(61.3%) пациентов выявлены изменения роговицы, которые выражались: 1.небольшой отек роговицы, 2. утолщение эпителия роговицы, 3. дистрофические изменения эпителия. 4. диффузные или локальные помутнения в нижнем и латеральном отделах роговицы.
В контрольной группе у 21 пациента (65,6%), наблюдались те же изменения в роговице, с аналогичной локализацией, при совпадении симптомокомплекса жалоб.
Давность трихиаза составляла от нескольких месяцев, до 17 лет. До операций пациентам обеих групп неоднократно выполнялись эпиляции. В контрольной группе мужчинам выполнялась эпиляция 59, в среднем 4,5 на пациента, женщинам 99, в среднем 5.2 на пациента, всего 158, или 4,9 на пациента. Неэффективность эпиляций заставили прибегнуть к более радикальным вмешательствам.
У двух пациентов (3 ресницы) выполнена лазеркоагуляция, обе - рецидив. Ротация сегментов хряща, при выраженном трихиазе, выполнена одной пациентке. Трихиаз устранён, но край века утолщён и гиперемирован. Остальным пациентам выполнены: термокоагуляция, диатермокоагуляция. (Таблица 6).
| Пациенты | Кол-во пациентов | количество оперированных ресниц | ресниц подлежало / удалено | % | |||
|---|---|---|---|---|---|---|---|
| лазер и ротац. | термо. | диатермо. | в среднем | ||||
| Мужчины | 13 | 0 | 14 | 75 | 6,7 | 89/122 | 39,7 |
| Женщины | 19 | 3/5 | 39 | 88 | 7,1 | 135/182 | 60,3 |
| Всего | 32 | 8 | 53 | 163 | 7,0 | 224/304 | 100 |
В контрольной группе из 32 пациентов количество неправильно растущих ресниц колебалось от 2 до 11, всего – 224, в среднем 7,0, вмешательства выполнены на 224 ресницах. При выполнении термо- и диатермокоагуляций неправильно растущих ресниц, удалено «дополнительно» 80 (26,8%) ресниц. Пациенты после операций наблюдались на протяжении от 1 года до 6 лет. Наиболее эффективными вмешательствами при локальном трихиазе, из числа традиционных методов, являются термокоагуляция (эффект 86.8 %) и диатермокоагуляция (эффект 100%). В послеоперационном периоде сроки выздоровления затягивались до 3-х недель.
Анализ операций ротации ресниц у пациентов с трихиазом
В основной клинической группе у мужчин было 86 эпиляций, в среднем 5.7, у женщин 101, в среднем 6.3 на пациента. Всего 187, или 6.1 на пациента, а у двух из них эпиляция и термокоагуляция. Выполненные вмешательства не привели к излечению от трихиаза. Низкая их эффективность, длительный период выздоровления, наличие осложнений привели к поиску путей решения проблемы трихиаза. У пациентов основной группы, помимо эпиляций, были другие вмешательства. У трех пациентов в анамнезе: операция по поводу холязиона, катаракты и пластика века слизистой губы. Способы разделены по вмешательствам на реснично-тканевом комплексе каждой ресницы. Их количество варьировало у одного от двух до 18-и, а всего у 31 пациента было 238 неправильно растущих ресниц. Ротаций ресниц также выполнено 238. Большинство -18 (58.1%) пациентов, имели по 5-8 неправильно растущих ресниц, при среднем количестве 8±3,46. (Табл.7).
| Пациенты | Количество пациентов | Операции на ресницах | % | Всего | |||
|---|---|---|---|---|---|---|---|
| трепан | ланцет | треугольн | в среднем | ||||
| Мужчины | 15 | 31 | 61 | 33 | 8,3 | 52,5 | 125 |
| Женщины | 16 | 29 | 34 | 50 | 7,1 | 47,5 | 113 |
| Всего | 31 | 60 | 95 | 83 | 7,6 | 100 | 238 |
Ланцетовидный способ выкраивания РТК (95 ресниц -39.9%) применялся к ресницам в центре века, углом контакта ресницы с роговицей около 90*, близко расположенные к нормально растущей реснице.
Треугольный способ выкраивания РТК (83 ресниц- 34.9%). применялся при той же локализации, углом контакта с роговицей около 120.
Трепаном выкраивания РТК(60 ресниц – 25.2%). при локализации во внутренней части века, в углах глаза, с любым углом контакта с роговицей.
Инъекции в веко раствора лидокаина и наложение окончатого зажима – пинцета повышало тургор мягких тканей и облегчало выделение РТК, его ротацию и фиксацию швами. Швы использовались 10/0, 8/0. У семи пациентов швы прорезались на 3-5 сутки, но РТК в новом положении закрепился. 11 ресниц не составили единый ресничный ряд.
При выполнении разработанных оперативных вмешательств, особое внимание уделялось сохранению сосудистого пучка, питающего волосяной фолликул, как главному условию жизнеспособности реснично-тканевого комплекса.
В ходе операций осложнений не отмечалось. В послеоперационном периоде: а) аллергический дерматит (у 1-го пациента) на местное применение раствора Левомитецина; б) гематома век (4 пациента); в) субконъюнктивальное кровоизлияние (3 пациента); г) смещение РТК от запланированного положения (11 (4.6%) случаях из 238).
После операции закапывали антибактериальные, кератопластические препараты, тауфон, закладывалась тетрациклиновая мазь. Кортикостероиды (гидрокортизон в каплях и мази) применялись у пациента с местной аллергической реакцией. 29 пациентов получало– УВЧ-терапию: на область оперированного века по 5 сеансов в нетепловой дозе. Двум пациентам физиотерапевтическое лечение противопоказано – онкология в анамнезе.
По операционному журналу в основной группе 31-у пациенту выполнена 101 операция, в среднем 3.3. Однако, объектом нашего исследования как анатомо-морфологического, так и клинического, является реснично-тканевой комплекс. Отдельная неправильно растущая ресница представляет из себя базовую, основополагающую единицу, своего рода наночастицу, трихиаза. Именно по этой причине мы считали число операций равным числу неправильно растущих ресниц. Такой подход обосновывал подсчёт количества выполненных вмешательств. Локализация и направление роста неправильно растущих ресниц определяли выбор вида вмешательства на разных ресницах в один операционный день одному и тому же пациенту. С другой стороны, близкое расположение неправильно растущих ресниц вынуждало ротировать их в отдельные операционные дни.
Классификация методов оперативного лечения трихиаза
По технологии оперативного лечения обширного трихиаза:
1.Оперативное лечение заворота века с пластикой аутотканью.
2.Оперативное лечение с пластикой аллотканью.
По технологии оперативного лечения локального трихиаза:
Традиционными методами:
-
Эпиляция волосяных луковиц неправильно растущих ресниц.
-
Термокоагуляция волосяных луковиц неправильно растущих ресниц.
-
Диатермокоагуляция волосяных луковиц неправильно растущих ресниц.
-
Лазеркоагуляция волосяных луковиц неправильно растущих ресниц.
Разработанными методами:
1. Ротация по оси реснично-тканевого комплекса (РТК). А)ланцетовидным выкраиванием; Б) треугольным выкраиванием; В) трепаном выкраивание;
2. Ротация по плоскости РТК А) ланцетовидным выкраиванием; Б)треугольным выкраиванием; В) трепаном выкраивание;
3. Ротация по оси с перемещением по плоскости РТК А) ланцетовидным выкраиванием; Б) треугольным выкраиванием; В) трепаном выкраивание,
Предлагаемая классификация делит оперативное лечение трихиаза на обширные вмешательства и дозированные хирургические усилия, ориентируя врача на работу с отдельными ресницами.
Заключение
Разработанные технологии микрохирургического лечения локального трихиаза на основе метода аутопластической ротации реснично-тканевого комплекса повысили эффективность лечения больных с трихиазом по количеству дней лечения на 28,6%, исключив рецидив трихиаза, алопецию, рубцовую деформацию краёв век.
На основании анализа распространённости трихиаза в ХМАО – Югра, составлен прогноз в потребности оперативного лечения трихиаза, выработана рабочая классификация трихиаза.
Исследование анатомо-морфологических характеристик реснично-тканевого комплекса у человека и экспериментальных животных (поросят) установило их идентичность, что позволило использовать веки поросят в качестве модели при разработке новых видов оперативного лечения трихиаза.
Разработаны три технологии микрохирургического лечения трихиаза способом ротации реснично-тканевого комплекса и экспериментально доказана возможность их выполнения. Определены показания к их применению.
Разработанные способы микрохирургического лечения трихиаза внедрены в клиническую практику, практику преподавания предмета, включая курсы переподготовки врачей. Сравнительный анализ результатов доказал клиническое, косметологическое, экономическое преимущество предлагаемых методов над традиционными.
Практические рекомендации
Разработанные технологии микрохирургического лечения локального трихиаза на основе метода аутопластической ротации реснично-тканевого комплекса легко выполнимы, не требуют материальных затрат и могут быть рекомендованы к широкому клиническому применению.
При выполнении микрохирургического лечения локального трихиаза на основе метода ротации реснично-тканевого комплекса рекомендуется использование окончатого зажима для выполнения операций «на сухом поле».
При выборе вида вмешательства необходимо ориентироваться а) на угол контакта ресницы с роговицей; б) на локализацию неправильно растущей ресницы; в) на распространённость трихиаза по веку (векам).
При использовании способов ланцетовидного и треугольного выкраивания реснично-тканевого комплекса достаточно наложения одного шва позади перемещённого комплекса. При использовании способа выкраивания трепаном реснично-тканевого комплекса необходимо наложение одного шва позади перемещённого комплекса и одного шва, фиксирующего комплекс.
При выборе оперативного лечения трихиаза после травм и ожогов лучше сфотографировать пациента и заранее определить пути перемещения РТК, с учётом имеющихся рубцов на веках. Смещение РТК возможно не только от края, но и к краю века, для формирования ресничного ряда.
Перечень работ, опубликованных по теме диссертации
-
Аутопластическое устранение трихиаза ротацией волосяных мешочков (предварительное сообщение) / В.Н.Канюков, А.М.Уваров // - Материалы V областной научно-практической конференции. «Интеграция традиционной, народной и академической медицины в системе здравоохранения». Оренбург, 2006, - С.66-67
-
Исправление трихиаза ротацией волосяного мешочка. / В.Н.Канюков, А.М.Уваров //, - Материалы V международного конгресса. «Доказательная медицина – основа современного здравоохранения », - Хабаровск, 2006, - частьI, - С.140-143
-
Аутопластическое устранение трихиаза методом ротации волосяных мешочков / В.Н. Канюков, А.М. Уваров//, - Вестник Оренбургского государственного университета. Новые технологии микрохирургии глаза.(Проблемы доказательной медицины), Оренбург, 2006,-С143-145.
-
Аутопластическое устранение трихиаза методом ротации волосяных мешочков. / В.Н.Канюков, А.М.Уваров //, - Вестник Оренбургского государственного университета. Новые технологии микрохирургии глаза. (Актуальные вопросы морфогенеза и регенерации в офтальмологии), Оренбург, 2007, - С122-125
-
Уваров А.М. Техническое обеспечение аутопластического устранения трихиаза методом ротации волосяных мешочков (Инструментарий к оперативному вмешательству) / В.Н.Канюков, Л.А.Белякова, и др. //, - II Межрегиональная научно – практическая конференция. «Современные аспекты деятельности медицинских сестёр в офтальмологии», Оренбург, 2008, – С.25-28
-
Уваров А.М О классификации трихиаза и методах его консервативного и хирургического лечения / В.Н.Канюков//, - «Морфологические ведомости». Труды Всероссийской научно-практической конференции «Клиническая анатомия и экспериментальная хирургия в XXI веке», - Оренбург, 2009, – С.260- 262
Изобретения по теме диссертации
1.Способ устранения трихиаза выкраивания трепаном реснично-тканевого комплекса с последующей ротацией неправильно растущей ресницы / А.М.Уваров, В.Н.Канюков, Ю.В.Канюкова //,- Положительное решение ФИПС на изобретение № 2009137609/20 (053158) от 12.10.2009г.
2.Способ устранения трихиаза треугольным выкраиванием реснично-тканевого комплекса неправильно растущей ресницы / А.М.Уваров, В.Н.Канюков, Ю.В.Канюкова //,- Положительное решение ФИПС на изобретение № 2009137610/20 (053159) от 12.20.2009г.
3. Способ устранения трихиаза ланцетовидным выкраиванием реснично-тканевого комплекса неправильно растущей ресницы / В.Н.Канюков, А.М.Уваров, Ю.В.Канюкова //, - Положительное решение ФИПС на изобретение № 2009137608/20 (053157) от 12.10.2009г.
4. Трепан В. Н. Канюкова – А. М. Уварова, / В.Н.Канюков, А.М.Уваров, В.И.Канюков //,- Положительное решение ФИПС на полезную модель № 2009137611/20 (053160) от 12.10.2009г.
5. Фиксатор сегментов мягких тканей, / В.Н.Канюков, А.М.Уваров, В.И.Канюков //,- Положительное решение ФИПС на полезную модель № 2009127659/22 (038465) от 20.07.2009г.
к содержанию | опубликовать статью
ОПТИМИЗАЦИЯ ХИРУРГИЧЕСКИХ МЕТОДОВ ЛЕЧЕНИЯ БОЛЬНЫХ С НАГНОИВШИМСЯ ЭПИТЕЛИАЛЬНЫМ КОПЧИКОВЫМ ХОДОМ
Валиева Э. К.
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
На основе клинических, лабораторных (микробиологических), цитологических, инструментальных исследований впервые показана целесообразность применения шовного материала «Абактолат» и биоматериала для замещения объемных дефектов тканей (Ту 42-2 537-2006) при хирургическом лечении НЭКХ. Установлено, что шовный материал «Абактолат» действует бактерицидно на раневую и внутрибольничную микрофлору, предупреждая развитие гнойно-воспалительных осложнений. Доказана высокая эффективность использования биоматериала для замещения объемных дефектов тканей при лечении глубоких ран крестцово-копчиково-ягодичной области.
Актуальность
Хирургическое лечение больных с нагноившимся эпителиальным копчиковым ходом (НЭКХ) по настоящее время является одной из нерешенных проблем хирургии, колопроктологии, что связано с длительными сроками лечения - от 30 до 60 дней, частыми гнойными осложнениями - 20-30%; рецидивами заболевания - от 1,5 до 30% (Дульцев Ю.В., Ривкин В.Л. 1988 г., Тимербулатов В.М., Куляпин А.В., 1989 г., Лаврешин П.Н. с соавт., 2000 г., Даценко 2003 г., Sondenaa K. et.al 1992, Rossi P. et.al 1993).
Несмотря на то, что хирургическому лечению НЭКХ посвящено большое число исследований, до сих пор дискутируются вопросы хирургической тактики и способов лечения (Гобеджишвили В.К. с соавт., 2000 г., Данилов Т.В., 2000 г., Башанкаев Н.Р. с соавт. 2003 г., Коплатадзе А.М. с соавт., 2003 г. Ривкин В.Л. 2003 г., Ан В.К., Воробьев А.В. 2005 г., Muller X.M. et.al, 1992). Многие специалисты придерживаются какого-либо одного способа оперативного лечения, без учета локализации, размеров и глубины раны, особенностей ягодично-крестцово-копчиковой области (Дульцев Ю.В., Ривкин В.Л. 1984г., Гобеджишвили В.К., Даценко Б.М., Сафонов А.М., 2002 г., Sondenaa K. et.al 1992, Palmieri B., Zozzi Z., 1994).
Простое вскрытие НЭКХ, нерадикальное иссечение (когда остаются первичные свищевые ходы), неполное иссечение стенок гнойной полости приводят к рецидиву заболевания. Чрезмерное натяжение тканей при подшивании краев раны ко дну или при наложении «глухих» швов приводит к образованию вторичных свищевых ходов и кожных «мостиков», что повышает риск развития нагноения раны, образования грубых послеоперационных рубцов и рецидивов заболевания (Куляпин А.В., 1989 г., Лаврешин Р.М. с соавт., 2000 г., Marino B.M., Drago Z.W., 1991)
Успех лечения НЭКХ зависит от разработки новой тактики хирургического лечения, которая бы учитывала анатомические особенности крестцово-копчиково-ягодичной области, размеры и локализацию гнойной полости, глубину раны, тканевое напряжение сшиваемых краев раны. Использование таких современных технологий, как антибактериальный шовный материал «Абактолат», «Аллотрансплантат для замещения объемных дефектов тканей», способствовали бы успеху лечения НЭКХ.
Все вышеперечисленное определило актуальность проведенного нами исследования.
Целью исследования являлось улучшение результатов хирургического лечения больных с нагноившимся эпителиальным копчиковым ходом.
Материалы исследования
В настоящей работе обобщены результаты анализа 845 историй болезни (из которых 759 с НЭКХ, 86 - с ЭКХ) и собственного обследования и лечения 433 больных НЭКХ, находившихся на лечении в колопроктологическом центре г.Уфы на базе ГКБ 21 с января 1995 г. по декабрь 2004 г.
Анализ по госпитализации показал, что общей тенденции к абсолютному увеличению числа больных за последние 10 лет не наблюдается. Отмечено, что больные в стадии гнойного воспалении госпитализируются в 7 раз чаще, чем в латентной стадии.
| Пол | Число больных по возрасту (n=759) | |||
|---|---|---|---|---|
| 15-20 лет | 21-30 лет | 31-40 лет | Старше 41 | |
| Мужчины | 59 (7,8%) | 273 (35,9%) | 137 (18,2%) | 63 (8,4%) |
| Женщины | 40 (5,3%) | 106 (13,9%) | 59 (7,8%) | 22(2,8%) |
| Всего | 99 | 379 | 196 | 85 |
Распределение больных по полу и возрасту представленные в таблице 1, подтверждает, что чаще всего НЭКХ развивается у лиц наиболее трудоспособного возраста и это имеет большое социально-экономическое значение.
Большинство больных - 583 (76,8 %) были госпитализированы на 2-4 сутки от начала заболевания. На 5-7-е сутки госпитализированы 106 больных (14%), на 9-19 сутки - 58 (7,6%), более чем через 10 суток - 12 (1,6%).
При лечении 102 больных был опробован шовный материал «Абактолат». Хирургический шовный материал с пролонгированным антибактериальным действием марки «Абактолат» (изготовитель ООО НПО «Башбиомед») получается путем импрегнации шелка, капрона или лавсана №№1-5 насыщенным спиртовым раствором эритромицина и закреплением антибиотика в структуре нити оболочкой из биосовместимого биодеструктируемого полимера, обладающего собственными противомикробными свойствами (сертификат соответствия №4992873).
У 19 больных при лечении глубоких ран, образовавшихся после иссечения НЭКХ, использовали биоматериал для объемной пластики .
«Аллотрансплантат для замещения глубоких дефектов тканей» разработан во Всероссийском Центре глазной и пластической хирургии под руководством профессора Мулдашева Э.Р. и производится в тканевом банке указанного центра в соответствии с требованиями технических условий № ТУ 42-2-537-2006, регистрационное удостоверение №29/10081201/3584-02.
Методы исследования
Всем больным проводили общеклинические, клинико-лабораторные исследования, оценивалось объективное состояние и местный статус.
Модифицированное рентгенологическое исследование НЭКХ выполнялось на рентгенологическом аппарате «Siregraph CF» фирмы Siemens (Германия).
Модификация рентгенологического исследования заключалась в контрастировании полости абсцесса йодсодержащим контрастом типа урографин. Металлической рамкой моделировалась визуально видимая часть (кожные проявления) гнойной полости с последующим рентгенологическим исследованием.
Ультрасонографию выполняли на аппарате «Алока» SSD 650 (Япония). Исследования проводились накожными конвексными датчиками с частотой 5 МГц.
Микробиологические исследования проводили по стандартной методике (Приказ Минздрава СССР №535 от 22 апреля 1985 года и методического письма Горьковского НИИ ЭМ, 1988 г.).
Измерение натяжения тканей швами проводили динамометром БВР-10-2М.
Гистологические исследования проводились после фиксации иссеченного в пределах «здоровых» тканей нагноившегося эпителиального копчикового хода в формалине с последующим окрашиванием срезов гематоксилином и эозином.
Цитологические исследования проводили по Камаеву М.Ф. (поверхностная биопсия) с окрашиванием препаратов по Романовскому-Гимза.
Статистическая обработка результатов исследования проведена на персональном компьютере IBM PC Pentium с использованием стандартного программного обеспечения – операционная система «Windows 98». Для статистического анализа использовались программы: «Microsoft Excel», «MedCalc», «Statistica for Windows». Во всех группах для каждого исследуемого показателя определяли среднее значение параметра, достоверность различий (t – критерий Стьюдента), среднее квадратичное отклонение, ошибку среднего. Изменения считали достоверными при вероятности ошибки p, меньшей или равной 0,05 (тест угловой трансформации Фишера).
Результаты исследований и их обсуждение
Результаты лучевых методов исследований.
Эффективность хирургического лечения НЭКХ зависит от радикальности иссечения стенок гнойной полости, затеков и свищей в пределах «здоровых» тканей. Вскрытие гнойной полости во время операции или оставление свищевого хода приводят в послеоперационном периоде к нагноению раны. В связи с этим, были проведены исследования по определению диагностической ценности модифицированного рентгенологического исследования и ультрасонографии.
На основании результатов рентгенологического исследования проводилось иссечение НЭКХ. Данный метод позволил у 38 из 39 больных иссечь НЭКХ в пределах «здоровых» тканей. По нашим расчетам, проведенным по методике, изложенной в монографии Михайлова А.М., (1994 г.), чувствительность модифицированного рентгенологического исследования при диагностике границ гнойной полости составила 97%, диагностике свищевых ходов и гнойных затеков - 78%.
Исследования информативности ультрасонографии, проведенные на 17 больных НЭКХ, показали следующие результаты: при диагностике границ гнойной полости чувствительность составила 88,2%, при диагностике свищевых ходов и затеков - 58,8%.
Таким образом, предложенное модифицированное рентгенологическое исследование является высокоинформативным методом при предоперационной диагностике гнойной полости, затеков и свищевых ходов у больных НЭКХ.
Микробиологические исследования. Результаты исследования посевов из гнойной полости НЭКХ представлены в таблицах 2 и 3.
| Вид микрофлоры | Число посевов n=65 | % |
|---|---|---|
| Staph.aureus | 15 | 23,1 |
| Staph.epidermidis | 15 | 23,1 |
| E.coli | 8 | 12,3 |
| Streptococcus | 2 | 3 |
| Staph.hyicus | 12 | 18,5 |
| St.intermedius | 1 | 1,5 |
| Смешанная флора | 12 | 18,5 |
Установлено, что из посевов гнойной полости наиболее часто высевались: Staph.aureus - 23%, Staph.epidermidis - 23%, Staph.hyicus - 18,5%, E.coli - 12,3% и смешанная микрофлора в 18,5% случаев.
| Вид микрофлоры | Число посевов n=50 | % |
|---|---|---|
| Staph.aureus | 10 | 20 |
| Ps.aeruginosa | 6 | 12 |
| Proteus | 7 | 14 |
| E.coli | 9 | 18 |
| Смешанная микрофлора | 19 | 36 |
На седьмые сутки после операции видовой и количественный состав микрофлоры ран менялся. Наиболее часто высевались: Staph.aureus - 20%, E.coli - 18%, Proteus - 14%, Ps.aeruginosa - 12% и смешанная микрофлора - 36%.
Анализ антибиотикочувствительности высеваемых штаммов представлен в таблице 4.
| Антибиотики | Вид микрофлоры | |||||
|---|---|---|---|---|---|---|
| Staph.aureus | E.coli | Streptococcus | Staph. epidermidis | Ps.aeruginosa | Staph.hyicus | |
| Оксациллин | ++ | _ | ++ | ++ | _ | ++ |
| Цефалотин | ++ | ++ | ++ | +++ | +++ | +++ |
| Эритромицин | +++ | ++ | ++ | +++ | ++ | +++ |
| Линкомицин | ++ | ++ | ++ | ++ | ++ | ++ |
| Гентамицин | _ | ++ | ++ | ++ | _ | ++ |
| Ампициллин | + | ++ | ++ | ++ | + | ++ |
| Имипенем | +++ | +++ | +++ | +++ | +++ | +++ |
| Амикацин | + | _ | _ | ++ | ++ | +++ |
| Нити «Абактолат» | ++ | ++ | ++ | +++ | ++ | +++ |
«-» нет чувствительности (рост колоний)
«+» слабая чувствительность (отсутствует рост колоний в зоне диаметром 10 мм от стандартного диска)
«++» средняя чувствительность (отсутствует рост колоний в зоне диаметром 10-15 мм от стандартного диска)
«+++» высокая чувствительность (отсутствует рост колоний в зоне диаметром 15 мм и более от стандартного диска).
Результаты исследований показали, что высеваемая микрофлора чувствительна к эритромицину, цефалотину, имипенему. Слабая чувствительность выявлена к гентамицину и ампициллину. Помимо этого, нами была установлена высокая чувствительность к шовному материалу «Абактолат» (изготовитель ООО НПО «Башбиомед»). Для объективной оценки эффективности шовного материала «Абактолат» на раневое заживление были проведены цитологические исследования ран на 2, 4 и 7 сутки после иссечения НЭКХ. 31 больному (основная группа) края раны подшивали нитями «Абактолат», 27 больным (контрольная группа) раны ко дну подшивали капроновыми нитями. Цитологические исследования показали, что на 4-е сутки в основной группе наблюдалось значительное уменьшение числа микрофлоры (обнаруживались только единичные микроорганизмы), уменьшалось количество нейтрофилов до 45-50%, до 35% увеличилось количество полибластов и фибробластов. В контрольной группе на 4-е сутки продолжали обнаруживаться группы микрофлоры, число нейтрофилов в ране составило 60%, полибластов и фибробластов 25%. На 7-е сутки в основной группе содержание нейтрофилов снизилось до 30%, микрофлора не обнаруживалась, в ране преобладали клетки грануляционной ткани (про- и фибробласты, макрофаги, полибласты, эндотелий, множественные клетки эпителия). В контрольной группе на 7-е сутки содержание нейтрофилов составило 50%, количество про- и фибробластов, полибластов, эндотелия - 40%, продолжали обнаруживаться единичные группы микрофлоры.
Таким образом, шовный материал «Абактолат», оказывая антибактериальное действие, способствует эффективному купированию гнойно-воспалительных явлений и тем самым ускоряет регенерацию раны.
Определение натяжения тканей швами
Проведенные нами клинические и морфологические исследования показали, что одной из частых причин нагноения и расхождения ран после иссечения НЭКХ является либо чрезмерное натяжение сшиваемых тканей с развитием ишемического некроза, либо оставление полостей в глубине раны в случае прорезывания швов. Сшивание тканей без учета диастаза краев раны, глубины и ригидности стенок, то есть проведение однотипных операций без учета различных анатомических вариантов крестцово-копчиково-ягодичной области повышает риск развития осложнений. С целью предупреждения таких осложнений нами были проведены исследования по определению оптимального натяжения сшиваемых тканей. Исследовали 3 группы больных. У 1-й группы пациентов (n=20) после иссечения НЭКХ образовывались раны выше межъягодичной складки размерами 4±0,8х2,5±0,7х1,7±0,5 см. Во 2-й группе (n=24) размеры ран были больше и составили 5,6±1,1х3,5±0,7х2,5±0,6 см. В 3-й группе (n=48) раны располагались в межъягодичной складке, размеры составили 6,2±1,2х2,0±1,0х2,8±0,4 см. Во всех этих группах при закрытии ран натяжение сшиваемых краев измеряли динамометром (в кг).
В первой группе проводили «глухое» ушивание ран швами по Донати. Во второй группе 11 больным было проведено подшивание краев раны ко дну, 13-и больным – «глухое» ушивание по Донати. В третьей группе 14-и больным проводили «глухое» ушивание, 15-и больным – подшивание краев раны ко дну. 19-и больным рану заполняли «Аллотрансплантатом для замещения объемных дефектов тканей» и ушивали наглухо. Результаты исследований представлены в таблице 5.
| Группы НЭКХ | Средние размеры раны, мм | Натяжение (кг) | Прорезы-вание швов (число больных) | |||
|---|---|---|---|---|---|---|
| длина | ширина | глубина | мужчины n=58 | женщины n=34 | ||
| I гр (n=20) | ||||||
| глухой шов по Донати | 40±8 | 25±7 | 17±5 | 2,8±0,1 | 2,4±0,8 | 1 |
| II гр. (n=24) | ||||||
а – подшивание краев раны ко дну (n=11) б – глухой шов (n=13) |
56±11
58,2 |
35±7
26,4 |
25±6
23,4 |
3,4±1,2
3,8±1,8 |
3,1±1,2
3,6±2,0 |
4
4 |
| III гр. (n=48) | ||||||
а – глухой шов (n=14) б-натяжение в глубине раны (n=15) в – «Аллотрансплантат для замещения объемных дефектов тканей» (n=19) |
52,80 54,7
62±12
|
23,35 24,8
20±10
|
26,40 28,2
28±4
|
3,0±0,8 4,2±1,3
2,8±0,3
|
2,8±1,1 4,0±1,8
2,5±0,3
|
6 8
-
|
В I группе прорезывание швов отмечено у одного больного, натяжение швами краев раны составило от 2,4±8 до 2,8±0,1 кг. Во II группе при подшивании краев раны ко дну прорезывание наблюдалось у 4 больных, натяжение краев раны составило 3,1±1,2 до 3,4±1,2 кг. При «глухом» шве прорезывание наблюдалось также у 4 больных, натяжение краев раны составило от 3,6±2,0 до 3,8±1,8 кг. В III группе при «глухом» шве прорезывание швов отмечено у 6-ти больных, натяжение краев раны составило от 2,8±1,1 до 3,0±0,8 кг. В этой же группе при подшивании краев раны ко дну прорезывание наблюдалось у 8-и больных, натяжение краев швами составило от 4,0±1,8 до 4,2±1,3 кг. При использовании «Аллотрансплантата для замещения объемных дефектов тканей» прорезывания швов не отмечено. Натяжение краев раны составило от 2,5±0,3 до 2,8±0,3 кг. Таким образом, на основе проведенных исследований видно, что необходим индивидуальный подход при ушивании краев ран, учитывающий их размер и локализацию.
Типы НЭКХ
Литературные данные (Блинничев Н.М., 1985 г., Бхимани И.К., 1997 г., Даценко Б.М.,2000 г.) и анализ 845 историй болезней свидетельствуют, что по настоящее время многие специалисты придерживаются одного или двух способов оперативного лечения НЭКХ, без учета локализации гнойной полости и анатомических особенностей крестцово-копчиково-ягодичной области. Такой подход не способствует оптимизации лечения. В связи с этим, на основе клинических и инструментальных исследований, нами расширены типы НЭКХ, представленные Куляпиным А.В. (1989 г.) и адаптированы к клинической практике.
IА тип – абсцесс диаметром до 3 см, располагающийся в межъягодичной складке в проекции первичного свищевого отверстия;
IБ тип – абсцесс диаметром до 3 см вне первичного свищевого отверстия в межъягодичной складке;
II тип - абсцесс диаметром более 3см выше межъягодичной складки;
IIIА тип – абсцесс диаметром более 3 см в межъягодичной складке;
IIIБ тип – абсцесс более 3 см, располагающийся в межъягодичной складке и выше нее;
IV тип – НЭКХ, осложненный флегмоной крестцово-копчиковой области с наличием вторичных свищей или без них;
VА тип – рецидивный НЭКХ с абсцессом в области послеоперационного рубца;
V Б тип – рецидивный НЭКХ с оставленным первичным свищевым ходом.
Из 433 больных с IА типом было 30 больных (6,9%), IБ типом – 35 (8,1%), II типом - 220 больных (50,8%). IIIА типом - 47 (10,9%), IIIБ типом – 60 (13,9%), IV типом – 11 (2,5%), VА типом – 13 (3,0%) , VБ типом – 17 (3,9%). Представленные нами типы имеют большое практическое значение при выборе способа оперативного лечения.
Всем поступившим больным с НЭКХ в первые часы с момента поступления под внутривенным наркозом проводилось оперативное лечение. 433 больных были оперированы в зависимости от типов НЭКХ. Ближайшие результаты (стационарно и амбулаторно) были прослежены у 362 больных. Отдаленные результаты (через 6-12 месяцев) - у 345-х больных.
При IА и IБ типах (n=65) после иссечения гнойной полости в пределах «здоровых» тканей образовывались раны размерами 3,8±0,4х2,4±0,3х1,8±0,6 см. При IА типе раны имели овальную форму, при IБ типе - каплевидную.
С целью выбора наиболее оптимального метода хирургического лечения нами была оценена эффективность 3-х методов: 1) иссечение с открытым ведением раны; 2) иссечение с «глухим» ушиванием раны капроновыми нитями; 3) иссечение с ушиванием нитями «Абактолат». В первой стадии раневого процесса (фаза гидратации, альтерации) всем больным проводилось однотипное лечение, заключающееся в промывании ран 0,02% водным раствором хлоргексидина и наложении повязок с мазью левосин или левомеколь. Во второй стадии раневого процесса (фаза дегидратации, грануляции, продуктивного воспаления) перевязки проводили с метилурациловой мазью.
| № п/п | Способ хирургического лечения | Число боль-ных | Ближайшие результаты | Отдаленные результаты | |||||
|---|---|---|---|---|---|---|---|---|---|
| сроки стац. леч. (дн.) | сроки амбул. леч. (дн.) | общие сроки леч. (дн.) | нагноение раны | число больных | наличие грубых рубцов | рецидив заболевания | |||
| 1. | Иссечение с открытым ведением раны | 25 | 8,4±0,3 | 28,5±1,6 | 36,9±1,1 | 8 (32%) | 20 | 2 (10%) | 2 (10%) |
| 2. | Иссечение с «глухим» ушиванием раны | 24 | 9,2±0,3 | 23,5±1,4 | 32,7±1,8 | 9 (37,5%) | 15 | 2 (13,3%) | - |
| 3. | Иссечение с ушиванием нитями «Абактолат» (основная гру-ппа) | 16 | 8,4±0,5 | *15,2±0,5 | *23,6±0,4 | 2 (12,5%) | 14 | - | - |
Примечание. * - при сравнении с контрольной группой р<0,05
При I типе НЭКХ у 25-и больных, которым было проведено иссечение с открытым ведением раны, сроки стационарного и амбулаторного лечения составили 36,9±1,1 дней, у 17-и раны зажили вторичным натяжением, у 8-и больных в послеоперационном периоде наблюдалось нагноение раны. Отдаленные результаты прослежены у 20-и больных, из них у 2-х выявлены грубые послеоперационные рубцы. В этой группе рецидивы наблюдались у 2 больных. Причиной рецидива явилось оставление первичного свищевого хода в межъягодичной складке.
Одномоментное иссечение НЭКХ с «глухим» ушиванием раны по Донати капроновыми нитями проведено 24-м больным. В этой группе у 9-и больных (37,5%) в послеоперационном периоде наблюдалось нагноение раны, что привело к снятию швов. В неосложненных случаях (n=15) швы снимались на 8-10 сутки. Средние сроки лечения в этой группе составили 32,7±1,8 дней, при этом у больных с нагноением раны сроки лечения составили 39±0,9 дней, без нагноения - 26,4±0,9 дня. В отдаленном периоде грубые послеоперационные рубцы наблюдались у 2 (9%) больных.
Одномоментное иссечение НЭКХ с «глухим» ушиванием раны нитями «Абактолат» проведено у 16-и больных. В этой группе нагноение раны наблюдалось у 2-х больных (12,5%). Общие сроки лечения (стационарного и амбулаторного) составили 23,6±0,4дня, что достоверно (р<0,05) свидетельствовало о преимуществе использования шовного материала «Абактолат».
Таким образом, наиболее оптимальным способом хирургического лечения при IА и IБ типах НЭКХ является иссечение с «глухим» ушиванием раны нитями «Абактолат».
Со II типом НЭКХ оперировано 220 больных (51%). Этот тип встречается наиболее часто. После иссечения НЭКХ II типа средние размеры ран составили 6,2±0,4х3,8±0,4х2,5±0,7 см. При этом типе нами были оценены 5 способов оперативного лечения.
| № п/п | Способ хирургического лечения | Число боль-ных | Ближайшие результаты | Отдаленные результаты | |||||
|---|---|---|---|---|---|---|---|---|---|
| сроки стац. леч. (дн.) | сроки амбул. леч. (дн.) | общие сроки леч. (дн.) | нагноение раны | число больных | наличие грубых рубцов | рецидив заболевания | |||
| 1. | Иссечение с открытым ведением раны | 102 | 9,2±0,6 | 35,3±0,8 | 44,5±0,9 | 26 (25,5%) | 82 | 8 (9,7%) | 2 (2,4%) |
| 2. | Иссечение с подшиванием краев раны ко дну капроновыми нитями | 61 | 10,6±0,7 | 22,2±2,1 | 32,8±1,2 | 12 (19,7%) | 57 | - | 2 (3,5%) |
| 3. | Иссечение с подшиванием краев раны ко дну с нитями «Абактолат» (основная группа) | 30 | 9,2±0,5 | *17,3±2,7 | *26,5±1,5 | 2 (6,6%) | 25 | - | 1 (4,0%) |
| 4. | Иссечение со вторич-ной аутодермоплас-тикой | 5 | 12,4±0,2 | 13,1±0,2 | 25,5±0,5 | 1 (20%) | 3 | 2 | - |
| 5. | Двухэтапная методика | 22 | 12,8±0,6 | 14,1±0,5 | 26,9±1,5 | - | 18 | - | - |
Примечание. * - при сравнении с контрольной группой р<0,05
Иссечение с открытым ведением раны проведено 102-м больным, Заживление раны у 76-и больных этой группы происходило вторичным натяжением, у 26-и больных наблюдалось нагноение раны (25,5%). Общие сроки нетрудоспособности составили 44,5±0,9 дней. Отдаленные результаты прослежены у 82 больных, у 2 (2,4%) больных выявлен рецидив заболевания, связанный с оставлением первичного свищевого хода в межъягодичной складке, грубые послеоперационные рубцы выявлены у 8 (9,7%) больных.
Операция иссечения с подшиванием краев раны ко дну капроновыми нитями проведена 61-му больному. Общие сроки нетрудоспособности составили 32,8±1,2 дня. Нагноение раны наблюдалось у 12-и больных (19,7%). Отдаленные результаты прослежены у 57-и больных, у 2-х (3,5%) выявлен рецидив заболевания, обусловленный в одном случае оставлением первичного свищевого хода, а в другом – формированием вторичного свищевого хода в центре послеоперационного рубца. Гистологическое исследование препарата в этом случае показало наличие полости, стенки которой были представлены грануляционной тканью.
Одномоментное иссечение с подшиванием краев раны ко дну шовным материалом «Абактолат» проведено 30-и больным. Общие сроки нетрудоспособности составили 26,5±1,5 дней, что было достоверно меньше (р<0,05 ) по сравнению с подшиванием капроновыми нитями. Нагноение ран отмечено у 2 больных (6,6%). Отдаленные результаты прослежены у 25 больных, ни у одного больного грубых послеоперационных рубцов не выявлено, рецидив обнаружен у одного больного (4,0%), связанный с оставлением первичного свищевого хода.
Иссечение со вторичной аутодермопластикой с расщепленным кожным лоскутом проведено 5-и больным. Общие сроки нетрудоспособности в этой группе больных составили 25,5±0,5 дня. Нагноение раны отмечено у одного больного. Отдаленные результаты прослежены у трех пациентов. У двух из них в области операционного доступа образовались выраженные косметические дефекты в виде овальных ямок размерами 7х3х1,5 см. В связи с наличием этих осложнений при II типе НЭКХ вторичная аутодермопластика больше не проводилась.
Двухэтапная методика оперативного лечения проведена 22-м больным. На I этапе вскрывали гнойную полость разрезом 3 см, после купирования гнойно-воспалительных явлений на 5-7 сутки проводилось радикальное иссечение гнойной полости в пределах «здоровых» тканей. Рану ушивали наглухо швами по Донати шовным материалом «Абактолат». Общие сроки нетрудоспособности в этой группе составили 26,9±1,5 дней, что достоверно меньше (р<0,05), по сравнению с таковыми при подшивании краев раны ко дну капроновыми нитями. Отдаленные результаты прослежены у 18 больных: осложнений не выявлено.
Таким образом, при II типе НЭКХ наиболее оптимальным способом лечения является иссечение гнойной полости с подшиванием краев раны ко дну нитями «Абактолат» или двухэтапная операция.
С IIIА и IIIБ типами НЭКХ оперировано 107 больных (24,7%). После иссечения НЭКХ III типа средние размеры ран составили 6,2±1,1х3,5±0,8х3,1±0,4 см. При этом типе нами были оценены 5 способов оперативного лечения.
| № п/п | Способ хирургического лечения | Число боль-ных | Ближайшие результаты | Отдаленные результаты | |||||
|---|---|---|---|---|---|---|---|---|---|
| сроки стац. леч. (дн.) | сроки амбул. леч. (дн.) | общие сроки леч. (дн.) | нагноение раны | число больных | наличие грубых рубцов | рецидив заболевания | |||
| 1. | Иссечение с открытым ведением раны | 51 | 9,2±1,2 | 38,1±2,2 | 47,3±3,4 | 13 (25,4%) | 47 | 6 (12,7%) | 2 (4,2%) |
| 2. | Иссечение с подшиванием краев раны ко дну капроновыми нитями | 16 | 12,4±1,5 | 32,4±2,5 | 44,8±2,0 | 5 (31,3%) | 11 | 1 (9%) | 1 (9%) |
| 3. | Иссечение с подшиванием краев раны ко дну с нитями «Абактолат» (основная группа) | 14 | 10,4±0,8 | *27,4±1,2 | *37,7±1,8 | 2 (14,2%) | 11 | - | - |
| 4. | Иссечение со вторичной аутодермоплас-тикой | 7 | 12,1±1,5 | 25,1±0,5 | 37,4±1,8 | 2 (28,5%) | 5 | 2 (40%) | - |
| 5. | Иссечение с применением «Аллотранспланта-та для замещения объемных дефектов тка-ней» и нитей «Абактолат» (основная группа) | 19 | 10,1±1,5 | *19,3±1,2 | *29,3±1,6 | 2 (10,5%) | 19 | - | - |
Примечание. * - при сравнении с контрольной группой р<0,05
Иссечение с открытым ведением раны проведено 51 больному. Общие сроки нетрудоспособности составили 47,3±3,4 дня. У 38-и больных заживление шло вторичным натяжением, у 13-и (25,4%) наблюдалось нагноение раны. Отдаленные результаты прослежены у 47-и больных. У 6-и (12,7%) в области операционного доступа выявлены грубые послеоперационные рубцы. У 2 (4,2%) больных обнаружен рецидив заболевания, обусловленный оставлением первичного свищевого хода в межъягодичной складке.
Иссечение с подшиванием раны ко дну капроновыми нитями проведено 16-и больным. В этой группе общие сроки нетрудоспособности составили 44,8±2,0 дня. Нагноение ран в послеоперационном периоде отмечено у 5-и (31,3%) больных. Отдаленные результаты прослежены у 11-и больных. У одного больного выявлено наличие грубого послеоперационного рубца, у другого - рецидив заболевания, что в обоих случаях связано с образованием полости.
Иссечение с подшиванием краев раны ко дну нитями «Абактолат» проведено 14-и больным. В этой группе общие сроки нетрудоспособности составили 37,7±1,8 дней, что также достоверно меньше (р<0,05) по сравнению со сроками нетрудоспособности у больных оперированных путем подшивания краев раны ко дну капроновыми нитями. Нагноение ран в послеоперационном периоде наблюдалось у 2-х (14,2%) больных. Отдаленные результаты прослежены у 11-и больных, осложнений не выявлено.
Иссечение со вторичной аутодермопластикой проведено 7-и больным. Аутодермопластику проводили на 5-7 сутки после очищения раны и появления грануляций. Полное приживление лоскута наблюдалось у 5-и больных, у 2-х больных в результате нагноения раны произошел лизис пересаженного кожного лоскута. Нагноение ран было связано с неадекватным дренированием. Общие сроки лечения в этой группе составили 37,4±1,8 дней. Отдаленные результаты прослежены у 5-и больных, у 2-х из них выявлен выраженный косметический дефект в области послеоперационной раны.
Иссечение с последующим заполнением полости раны «Аллотрансплантатом для замещения объемных дефектов тканей» (производства тканевого банка Всероссийского центра глазной и пластической хирургии) проведено 19 больным. Этот биоматериал применялся на 5-7 сутки после очищения раны, фиксировался ко дну и краям раны шовным материалом «Абактолат». В этой группе общие сроки лечения составили 29,3±1,6 дня. Нагноение раны в послеоперационном периоде отмечено у 2-х (10,5%) больных с IIIБ типом НЭКХ. В обоих случаях причиной нагноения явилось неполное закрытие аллотрансплантата краями раны. Отдаленные результаты прослежены у 19 больных. Осложнений не выявлено.
Таким образом, при IIIА и IIIБ типах НЭКХ наиболее оптимальным методом хирургического лечения является применение «Аллотрансплантата для замещения объемных дефектов тканей» и шовного материала «Абактолат».
С IV типом НЭКХ нами было оперировано 11 больных. Всем больным проводилось широкое вскрытие флегмоны и иссечение вторичных свищевых ходов. При этом образовывались раны площадью от 25 см2 до 40 см2. Результаты лечения представлены в таблице 9.
| № п/п | Способ хирургического лечения | Число боль-ных | Ближайшие результаты | Отдаленные результаты | |||||
|---|---|---|---|---|---|---|---|---|---|
| сроки стац. леч. (дн.) | сроки амбул. леч. (дн.) | общие сроки леч. (дн.) | нагноение раны | число больных | наличие грубых рубцов | рецидив заболевания | |||
| 1. | Широкое вскрытие НЭКХ; иссечение вторичных сви-щей и открытое ведение раны | 5 | 16,4±1,2 | 52,3±1,2 | 68,4±2,5 | 2 | 4 | 4 | - |
| 2. | Широкое вскрытие НЭКХ; иссечение вторичных сви-щевых ходов, вторичная аутодермопластика (основ-ная группа) | 6 | 15,3±1,5 | *22,4±2,1 | *37,7±2,6 | 2 | 5 | 2 | - |
Примечание. * - при сравнении с контрольной группой р<0,05
5-и больным с IV типом НЭКХ проведено широкое вскрытие флегмоны, иссечение вторичных свищевых ходов с последующим открытым ведением раны. У 3-х больных заживление проходило вторичным натяжением, у 2-х больных наблюдалось нагноение раны. Общие сроки нетрудоспособности составили 68,4±2,5 дня. Отдаленные результаты прослежены у 4-х больных: у всех обнаружены грубые послеоперационные рубцы в крестцово-копчиковой области.
6-и больным с IV типом НЭКХ на 6-7 сутки после очищения раны и появления грануляций проводилась вторичная аутодермопластика расщепленным кожным лоскутом толщиной 0,3 мм. Полное приживление кожных лоскутов отмечено у 4-х больных, у 2-х больных наблюдался частичный лизис кожного трансплантата. Общие сроки нетрудоспособности составили 37,7±2,6 дней. Таким образом, сроки лечения были достоверно меньше (р<0,05) по сравнению с таковыми при открытом ведении заживления ран. Отдаленные результаты прослежены у 5-и больных. У 2-х из них выявлены косметические дефекты в виде углублений в крестцово-копчиковой области.
Таким образом, при IV типе НЭКХ наиболее оптимальным методом хирургического лечения является широкое вскрытие флегмоны, иссечение вторичных свищевых ходов с последующим проведением вторичной аутодермопластики расщепленным кожным лоскутом.
Результаты оперативного лечения больных НЭКХ V типа представлены в таблице 10.
| № п/п | Способ хирургического лечения | Число боль-ных | Ближайшие результаты | Отдаленные результаты | |||||
|---|---|---|---|---|---|---|---|---|---|
| сроки стац. леч. (дн.) | сроки амбул. леч. (дн.) | общие сроки леч. (дн.) | нагноение раны | число больных | наличие грубых рубцов | рецидив заболевания | |||
| 1. | Иссечение НЭКХ с под-шиванием краев раны ко дну капроновыми нитями | 19 | 14,1±1,5 | 31,1±1,2 | 45,3±1,3 | 3 (15,7%) | 3 | - | - |
| 2. | Иссечение НЭКХ с под-шиванием краев раны нитями «Абактолат» (основная группа) | 11 | 13,1±1,2 | 27,1±1,5 | *40,2±1,2 | 1 (9%) | 6 | - | - |
Примечание. * - при сравнении с контрольной группой р<0,05
При V типе НЭКХ (рецидивная форма) оперировано 30 больных, из них 19-и больным проведено иссечение с подшиванием капроновыми нитями, 11-и - иссечение гнойной полости и рубцовых тканей с подшиванием краев раны ко дну нитями «Абактолат». Общие сроки лечения при подшивании капроновыми нитями составили 45,3±1,3 дня, а с нитями «Абактолат» - 40,2±1,2 дня. При подшивании капроновыми нитями у 3-х (27,2%) больных, наблюдалось нагноение раны. Отдаленные результаты: осложнений в обеих группах не выявлено.
Таким образом, при V типе НЭКХ наиболее оптимальным методом хирургического лечения является иссечение с подшиванием краев раны ко дну нитями «Абактолат».
Заключение
При традиционных способах оперативного лечения больных с НЭКХ без учета особенностей крестцово-копчиково-ягодичной области, локализации гнойной полости, ее размеров в послеоперационном периоде в 15%-37% случаев наблюдаются гнойные осложнения, сроки нетрудоспособности составляют от 38,7±1,8 до 68,4±2,5 дня.
Выбор способа оперативного лечения НЭКХ должен быть дифференцированным и определяться типом заболевания. Наиболее оптимальным способом хирургического лечения при I типе является иссечение НЭКХ в пределах здоровых тканей с «глухим» ушиванием раны нитями «Абактолат»; при II типе – иссечение с подшиванием краев раны ко дну нитями «Абактолат»; при III типе – иссечение с последующим заполнением раны «Аллотрансплантатом для замещения объемных дефектов тканей»; при IV типе – иссечение со вторичной аутодермопластикой расщепленным кожным лоскутом; при V типе – иссечение с подшиванием краев раны ко дну нитями «Абактолат». Разработанные способы хирургического лечения позволяют сократить сроки нетрудоспособности на 6,3±0,3 - 30,7±0,1 дней и уменьшить число гнойных осложнений на 13%-25%.
Синтетический шовный материал «Абактолат» действует бактерицидно как на микрофлору, высеваемую у больных НЭКХ, так и на внутрибольничную инфекцию; его использование при различных способах оперативного лечения способствует уменьшению нагноения раны от 13,1% до 25%.
Применение «Аллотрансплантата для замещения объемных дефектов тканей» при глубоких ранах после иссечения III типа НЭКХ способствует сокращению сроков нетрудоспособности на 18±1,8 дней и предупреждает образование грубых рубцов.
Практические рекомендации
Оперативное лечение НЭКХ необходимо проводить в зависимости от локализации и размеров гнойной полости и в соответствии с выделенными типами данной патологии:
При патологическом очаге диаметром менее 3 см находящимся в межъягодичной складке (I тип), наиболее оптимальным способом оперативного лечения является иссечение гнойной полости в пределах здоровых тканей и «глухое» ушивание раны нитями «Абактолат» по Донати.
При НЭКХ диаметром более 3 см (IIтип) находящимся выше межъягодичной складки, наиболее оптимальным способом оперативного лечения является иссечение с подшиванием краев раны ко дну нитями «Абактолат».
При гнойной полости больших размеров, находящейся в межъягодичной складке и выше ее (III тип), наиболее оптимальным является иссечение НЭКХ с последующим заполнением полости раны «Аллотрансплантатом для замещения объемных дефектов тканей» с фиксацией последнего нитями «Абактолат».
При НЭКХ, расположенном в крестцово-копчиковой области с множественными ответвлениями в ягодичную область (IV тип), наиболее оптимальной операцией является вскрытие флегмоны и иссечение вторичных свищевых ходов с последующей аутодермопластикой на 5-7 сутки.
При рецидивных формах НЭКХ (V тип), когда гнойная полость находится в крестцово-копчиковой области, наиболее оптимальным способом хирургического лечения является иссечение НЭКХ с подшиванием краев раны ко дну шовным материалом «Абактолат».
При оперативном лечении НЭКХ, с целью уменьшения гнойных осложнений, необходимо иссекать гнойную полость в пределах «здоровых» тканей. Модифицированное рентгенологическое исследование с наложением металлической рамки способствует более точному определению границ гнойной полости.
Шовный материал «Абактолат» действует бактерицидно как на микрофлору, высеянную из раны, так и на внутрибольничную инфекцию. Применение шовного материала «Абактолат» способствует более быстрому купированию гнойно-воспалительных явлений и этим ускоряет заживление ран.
«Аллотрансплантат для замещения объемных дефектов тканей» способствует значительному сокращению сроков лечения и предупреждает развитие косметических дефектов. Обязательным условием применения «Аллотрансплантата для замещения объемных дефектов тканей» является полное его закрытие кожными краями раны.
Литература
1. Опыт лечения эпителиальных копчиковых ходов в стадии абсцедирования / Э.К.Валиева, А.В.Куляпин, И.Л.Шенбергер, Д.Х.Амирова //Актуальные вопросы клинической медицины: тезисы докладов. - Уфа, 1994. - С.77-79.
2. Валиева Э.К. Пункционная абсцессография при эпителиальных копчиковых ходах в стадии абсцедирования. /Э.К.Валиева, А.В.Куляпин, И.И.Хидиятов //Российский журнал гастроэнтерологии, гепатологии и колопроктологии. - 1997. – Т.8, Прил. №4-5. - С.259.
3. Валиева Э.К. Аутодермопластика расщепленным лоскутом в лечении эпителиального копчикового хода в стадии абсцедирования. /Э.К.Валиева, А.В.Куляпин, И.И.Хидиятов //Российский журнал гастроэнтерологии, гепатологии и колопроктологии – 1997. - Т.7, Прил. №4-5. - С.270.
4. Валиева Э.К. Опыт лечения рецидивных эпителиальных копчиковых ходов /Э.К.Валиева, А.В.Куляпин, И.И.Хидиятов //Проблемы колопроктологии - М. - 1998. - Вып.№16. - С.68-70.
5. Валиева Э.К. Применение «Абактолата» при лечении нагноившихся эпителиальных копчиковых ходов в стадии абсцедирования /Э.К.Валиева, А.В.Куляпин, Ф.М.Гайнутдинов. //«Новые технологии в хирургии» и Пленума проблемной комиссии РАМН «Колопроктология» и Правления ассоциации колопроктологов России: сборник тезисов III научно-практической конференции. – Уфа. - 1998. - С.133-134.
6. Хирургические методы лечения эпителиального копчикового хода и его осложнений /Э.К.Валиева, А.В.Куляпин, И.И.Хидиятов, Ф.М.Гайнутдинов //Здравоохранение Башкортостана. – 2000. - №4, С.29-31.
7. Валиева Э.К. Хирургическая тактика при лечении рецидивных эпителиальных копчиковых ходов /Э.К.Валиева, А.В.Куляпин, И.И.Хидиятов //Актуальные вопросы колопроктологии. – Уфа. - 2002 - С.84-85.
8. Валиева Э.К. Лечение эпителиального копчикового хода в стадии абсцедирования /Э.К.Валиева, А.В.Куляпин, И.И.Хидиятов //Актуальные вопросы колопроктологии: тезисы докладов. - Уфа, 2002 . - С.87-88.
9. Хирургическая тактика при лечении эпителиального копчикового хода в стадии абсцедирования /Э.К.Валиева, А.В.Куляпин, И.И.Хидиятов, Ф.М.Гайнутдинов //Актуальные вопросы колопроктологии: тезисы докладов - Самара, 2003 - С.87-88.
10. Оптимизация методов хирургического лечения больных с нагноившимся эпителиальным копчиковым ходом /Э.К.Валиева, И.И.Хидиятов, А.В.Куляпин, Л.Ш.Сафинова //Научный прорыв - 2005: сб. науч. тр. конф. ученых РБ. – Уфа. - С.41-42.
11. Возможности использования стимулятора регенерации в лечении проктологических заболеваний. /Э.К.Валиева, А.В.Куляпин, Р.Я.Биганяков, М.Ю.Батталов, Р.Р.Булатов Р.Р. //Актуальные проблемы колопроктологии: материалы научно-практической конференции с международным участием. – М. – 2005. - С.96.
к содержанию | опубликовать статью
УВЕЛИЧЕНИЕ ОБЪЕМА КОСТНОЙ ТКАНИ АЛЬВЕОЛЯРНОГО ОТРОСТКА С ИСПОЛЬЗОВАНИЕМ АЛЛОТРАНСПЛАНТАТА
Мулдашев Э.Р., Щербаков Д.А., Штеренберг Д.Г.
ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию», г. Уфа
В эксперименте на кроликах Шиншилла изучены особенности замещения аллогенного и ксеногенного измельченных костных трансплантатов, а также сроки формирования регенерата. Выявлено соответствие скорости резорбции аллотрансплантата с процессами остеогенеза, что позволяет получить адекватный регенерат в финале заместительной регенерации.
Актуальность исследования
На фоне широкого внедрения дентальной имплантации возникает нестабильность имплантов вследствие дефицита костной ткани. Известно, что плотность костной ткани альвеолярного отростка верхней челюсти снижается после потери зубов [9].
Восстановление анатомических объёмов костной ткани альвеолярного отростка - одна из основных задач подготовки протезного ложа. При этом используются различные материалы. Аутотрансплантация ограничена дополнительной травматизацией, риском инфицирования, дефицитом материала [2, 4, 7].
В.К. Цогоев [8] и O.T. Jensen [9] подчеркивают, что остаются открытыми вопросы реакции тканевого ложа на тот или иной синтетический материал. В связи с чем наиболее перспективным считается использование биологических материалов ксеногенного и аллогенного происхождения.
В челюстно-лицевой хирургии успешно применяется костный аллотрансплантат производства ФГУ «Всероссийский центр глазной и пластической хирургии» (г. Уфа) [5]. Трансплантаты данной серии имеют ряд преимуществ: низкая иммуногенность, стимуляция регенеративных процессов в зоне введения, постепенное замещение биоматериала костным регенератом [4]. Также доказаны остеоиндуктивные свойства указанных трансплантатов [3]. Однако, остаются нераскрытыми вопросы замещения измельченных форм костных биоматериалов при выполнении операции синус-лифтинга.
Учитывая изложенное сформулирована цель настоящего исследования: экспериментально-морфологически обосновать возможность применения костного аллотрансплантата, при выполнении операции по поднятию дна верхнечелюстной пазухи для проведения дентальной имплантации.
Материалы и методы
На базе отдела морфологии ФГУ «Всероссийский центр глазной и пластической хирургии Министерства здравоохранения и социального развития» (г. Уфа) выполнены экспериментальные исследования на 20 кроликах породы Шиншилла. Авторы работы руководствовались «Европейской конвенцией относительно защиты позвоночных животных, которые используются с экспериментальными и другими научными целями» (Страсбург, 1986).
Под наркозом у животного производился разрез под верхней губой на 2 мм ниже переходной складки на слизистой преддверья рта, после чего обнажалась передняя стенка верхнечелюстной пазухи на уровне её дна. Затем бором формировалось окно в костной стенке пазухи высотой до 5-6 мм, длинной до 1 см, не повреждая внутреннюю выстилку пазухи. Слизистая оболочка пазухи отсепаровывалась от кости кюреткой. Сформированное пространство заполнялось костным алло- (опытная серия) или ксенотрансплантатом (контрольная серия). Затем производилось ушивание слизистой преддверья рта. На 45-е, 90-е и 180-е сутки эксперимента выполнялся забор материала. Гистологические препараты, после окраски гематоксилином и эозином по Маллори и Ван-Гизону, изучались в поляризационном микроскопе «МИН-8», и в световом микроскопе MC-50 с фотонасадкой. Использовалась морфометрическая программа Biovision 3.0, а также Microsoft Office Excel 2010 и Statistica 8.0. Для оценки полученных результатов в двух сериях опытов применялся параметрический метод (t-критерий Стьюдента для независимых групп).
Реактивные процессы в нижней стенке верхнечелюстной пазухи при операции синус-лифтинга с использованием ксеногенного костного трансплантата. 45-е сутки. В зоне трансплантации определяются фрагменты измельченного костного биоматериала. Важно отметить, что в трансплантате не определяются клеточные элементы. В периферической зоне определяется формирование терминального сосудистого русла, представленного капиллярами. Указанные явления сопровождаются паравазальной инфильтрацией. В инфильтрате преобладают клетки макрофагального и фибробластического дифферонов, обнаруживаются нейтрофильные лейкоциты (микрофаги) и лимфоциты. Вокруг частиц биоматериала обнаруживаются макрофаги, участвующие в их резорбции. Пространства, между фрагментами трансплантата заполняются рыхлой неоформленной соединительной тканью (рис. 1).
Рис. 1 Экспериментальный синус-лифтинг с использованием ксенотрансплантата (контрольная серия). 45-е сутки. 1-фрагмент костного биоматериала; 2-незначительные явления плазморрагии в очаге трансплантации. Окраска гематоксилином и эозином. Об. 40, ок. 20.
90-е сутки. Происходит дальнейшая резорбция частиц измельченного биоматериала. В микропрепаратах определяются редкие фрагменты трансплантата, отмечается формирование зрелых волокон коллагена. Следует отметить разнонаправленную ориентацию коллагеновых волокон. Полиморфно-клеточная инфильтрация на месте введения трансплантата менее выражена, чем в ранние сроки. Сохраняется макрофагальная реакция. Активация макрофагов вызвана присутствием гликозаминогликанов в составе биоматериала. В процессе резорбции трансплантата макрофагами эксперессируются цитокины, активирующие синтетическую функцию фибробластов, и, по-видимому, миграцию клеток остеобластического дифферона в очаг трансплантации. Происходило образование регенерата из балок ретикулофиброзной кости и неоформленной соединительной ткани. Вокруг балок ретикулофиброзной кости располагалось большое количество остеобластов.
В указанной области отмечается большое количество вновь синтезированных волокон коллагена. В периферической зоне относительно крупные артериолы и венулы ориентированы по ходу формирующихся пучков.
В реактивной зоне выявляются функционирующие терминальные микрососуды и единичные недифференцированные соединительнотканные клетки. Периферическая зона биоматериала имеет размытые границы. В указанной зоне происходит дифференцировка и редукция сосудов, организация коллагеновых волокон в пучки с появлением в них извилистости. Фибробласты постепенно превращаются в дефинитивные формы.
В финале репаративных процессов на 180-е сутки на месте бывшего ксенотрансплантата обнаруживается ретикулофиброзная костная ткань с включениями гиалинового хряща и плотной неоформленной соединительной ткани (Рис. 2). При этом отмечается значительная резорбция пересаженного биоматериала. Объем регенерата составляет лишь 43% от изначально введенного объема измельченного трансплантата. По-видимому, в более поздние сроки происходит ремоделирование регенерата, обусловливающее постепенное формирование пластинчатой компактной и губчатой кости [1].
Рис. 2. Экспериментальный синус-лифтинг с использованием ксенотрансплантата (контрольная серия). 180-е сутки. 1-ретикулофиброзная костная ткань; пунктиром отмечена поливекторная ориентация коллагеновых волокон и костных балок. Окраска по Ван-Гизону. Об. 40, ок. 20.
Репаративные процесся костной ткани при поднятии дна верхне-челюстной пазухи. 45-е сутки. В области аллотрансплантации также определяется полиморфноклеточная инфильтрация. При этом в инфильтрате не верифицируются клетки лимфоцитарного и лейкоцитарного дифферонов, однако обнаруживаются вторичные остеобласты. Последние имеют овальную форму и многочисленные длинные отростки.
Измельченный биоматериал определялся в виде гомогенных частиц разной величины, инфильтрованных небольшим количеством мононуклеарных клеток и тканевых базофилов. Фрагменты костного трансплантата подвергались интенсивной деградации и лизису, о чем свидетельствовало изменение тинкториальных свойств. Биоматериал, имел структурную организацию пластинчатой костной ткани. Наибольшая концентрация макрофагов наблюдалась в зоне контакта частиц измельченного биоматериала с окружающими тканями. Здесь, происходит активная резорбция биоматериала макрофагами. Обращало на себя внимание присутствие в инфильтратах только единичных лимфоцитов и появление в окружающих сосудах значительного количества моноцитов со светлой цитоплазмой и темным овальным или бобовидным ядром.
В периферической зоне наблюдалась активная сосудистая реакция окружающей ткани. Область подсадки трансплантата обильно кровоснабжалась. Сосуды из окружающих тканей беспрепятственно прорастают в область трансплантации, это объясняется не только измельченной структурой биоматериала, введённого в данную область, но и стимулирующим эффектом биоматериала на процессы васкуляризации.
90-е сутки. Происходит дальнейшая резорбция частиц измельченного биоматериала. Большая часть резорбированного диспергированного биоматериала замещена новообразованной плотной оформленной соединительной тканью. Выраженной инфильтрации макрофагами области подсадки трансплантата не наблюдается. Однако увеличивается количество юных форм фибробластов. Скорость резорбции биоматериала в данной серии сбалансирована со скоростью фибриллогенеза. Одним из подтверждений этой гипотезы является обнаружение новообразованных волокон коллагена окружающих фибробласты в периферической зоне (Рис. 3).
В этот срок наиболее примечательна периферическая зона или зона ремоделирования. Это зона с наиболее размытыми границами, где происходит дифференцировка и редукция сосудов, организация коллагеновых волокон в пучки с появлением в них волнистости с постепенно увеличивающейся амплитудой, где фибробласты постепенно превращаются в фиброциты. Она следует за зоной пролиферации и по периферии постепенно переходит в сформировавшийся адекватный регенерат. При этом, сохраняется первоначальный объём, полученный во время инъекции. При окраске по Ван-Гизону в центральной зоне биоматериала четко определяются фрагменты трансплантата, окруженные розовыми тяжами новообразованных .
Сформированный регенерат, представляющий собой плотную оформленную волокнистую ткань с относительно большим, чем в окружающих тканях количеством клеточных элементов и сосудов. При этом в регенерате менее выражена извилистость коллагеновых волокон и плотность их упаковки. Обнаруживаются очаги вторичного остеогенеза, как этап формирования костного регенерата (Рис. 3).
Рис.3. Экспериментальный синус-лифтинг с использованием аллотрансплантата (опытная серия). 90-е сутки. 1-очаги фибриллогенеза; 2-очаги остеогенеза. Окраска гематоксилином и эозином. Об. 10, ок. 20.
180-е сутки. Изучение гистологических препаратов, полученных в более поздние сроки, показало, что процессы резорбции фрагментов трансплантата сбалансированы во времени с процессами образования регенерата. Т.е. заместительная регенерации в опытной серии протекает более медленно, за счет низкого уровня реактивных процессов в очаге введения биоматериала. В отдаленные сроки эксперимента в области трансплантации определяется пластинчатая костная ткань, которая мало отличается от ткани альвеолярного гребня (Рис. 4). При этом в полученном регенерате обнаруживаются единичные хрящевые клетки в виде отдельных небольших островков «изогенных групп». При этом объем полученного регенерата составляет 67% от изначально введенного объема аллотрансплантата. По-видимому, в более поздние сроки происходит ремоделирование регенерата, обусловливающее постепенное формирование пластинчатой компактной и губчатой кости.
Рис. 4. Экспериментальный синус-лифтинг с использованием аллотрансплантата (опытная серия). 180-е сутки. 1-слизистая оболочка; 2-подслизистый слой; 3-надкостница; 4-компактная костная ткань. Окраска по Ван-гизону. Об. 40, ок. 20.
Для оценки качества полученного регенерата использовался показатель объема губчатой кости [9]. Последний представляет собой отношение площади костной ткани к исследуемой площади гистологического препарата, выраженное в процентах. Указанный показатель оценивался на 180-е сутки (финал процессов замещения трансплантата). В норме у человека в альвеолярном отростке верхней челюсти данный показатель составляет 10-30% (у женщин) и 12-37% (у мужчин) [9]. У кролика в норме указанный показатель варьирует от 46 до 66%. В контрольной серии объем губчатой кости регенерата был равен 32±10%, а в опытной - 48±11% (p>0,05).
Плотность костной ткани альвеолярного отростка верхней челюсти кролика в среднем на 30% выше, чем у человека, что, по-видимому, обусловлено особенностями строения черепа животного (изначальное отсутствие зубов в проекции дна верхнечелюстной пазухи). При этом высота альвеолярного отростка в проекции пазухи значительно меньше, чем в центральных его отделах (область резцов).
Заключение
Измельченный аллотрансплантат при подсадке под мембрану Шнайдера с целью увеличение объема костной ткани альвеолярного отростка верхней челюсти постепенно замещается собственными тканями реципиента. При этом формируется структура соответствующая пластинчатой костной ткани. Однако плотность регенерата, оцененная по объему губчатой кости в двух сериях опытов, имеет недостоверные различия. При этом отмечается тенденция к увеличению плотности костной ткани в опытной серии.
На основании результаты экспериментальных исследований, учитывая достаточный объем регенерата и адекватность его структуры, возможно использование измельченного костного аллотрансплантата в клинической практике при выполнении операции синус-лифтинга.
Литература
-
Актуальные проблемы теоретической и клинической остеоартрологии / Денисов-Никольский Ю.И., Миронов С.П., Омельяненко Н.П., Матвейчук И.В. // - М., ОАО «Типография «Новости», 2005. – 336с.
-
Беззубов, А.Е. Сравнительная оценка применения костнопластических материалов для замещения дефектов челюстей (клинико-экспериментальное исследование): автореф. дис. ... канд. мед. наук. - Самара, 2010. - 24.
-
Булатов, А.А. Современные способы изготовления, стерилизации и консервации деминерализованных костных трансплантатов / А.В. Калинин, В.И. Савельев // Травматология и ортопедия России. - № 1(34). - СПб, 2005. – С. 55-59.
-
Нигматуллин, Р.Т. Морфологические аспекты пересадки соединительнотканных аллотрансплантатов: автореф. дис. … д-ра мед. наук. – Новосибирск, 1996. – 40с.
-
Радкевич, А.А. Реконструктивная хирургия альвеолярных отростков челюстей : автореф. дис. ... канд. мед. наук. - Иркутск, 2002. - 33 с.
-
Сельский, Н.Е. Применение биоматериалов «Аллоплант» в челюстно-лицевой хирургии. – Уфа: Здравоохранение Башкортостана, 2000. – 224с.
-
Федоровская, Л.Н. Экспериментально-клиническое обоснование применения хирургических методов увеличения объема костной ткани альвеолярного отростка при его атрофии на этапах зубной имплантации : автореф. дис. ... канд. мед. наук. - М, 2002. - 29.
-
Цогоев, В.К. Обоснование использования биорезорбируемых средств при непосредственной и ранней отсроченной дентальной имплантации: автореф. дис. ... канд. мед. наук. - М, 2007. - 25.
-
Ole T. Jensen. The Sinus Bone Graft. Quintessence Pub Co. – 2006. – 205p.